Jedes Jahr kommt es bei uns zu etwa 11.000 bis 13.000 neuen Fällen von Borreliose. Jährlich werden trotz aktiver Immunisierung auch Hunderte von Patient:innen mit Frühsommer-Meningoenzephalitis (FSME) gemeldet, im Jahr 2020 waren es 705 Fälle. Mit der Borreliose zählt die FSME in Europa zu den häufigsten zeckenübertragenen Infektionskrankheiten. Schuld daran sind heimische Zecken. Als besonders gefährliche Krankheitsüberträger gelten ihre tropischen Artgenossen, die derzeit auch Deutschland für sich entdecken.
Die Zeckenart Hyalomma marginatum, die sich sonst eher in subtropischen Gefilden wohlfühlt (Nordafrika, Asien) und eine Vielzahl von Erkrankungen übertragen kann, wurde erstmals 2019 in Deutschland entdeckt. Hyalomma-Zecken haben – im Gegensatz zum heimischen Holzbock – Augen (griechisch: Hyalos = Glas; omma = Auge). Sie sind sehr schnelle und sich optisch orientierende aktive Jäger, ihren potenziellen Wirt verfolgen sie über Hunderte von Metern. Hyalomma marginatum ist Überträger verschiedenster Krankheitserreger, u. a. des Krim-Kongo-Hämorrhagische-Fieber-Virus – es kann das gefährliche Krim-Kongo-Fieber auslösen. Auch Babesien können durch diese Zeckenart übertragen werden. Das sind einzellige Parasiten, die Erythrozyten infizieren und dann zu einer malariaähnlichen Erkrankung mit Hämolyse führen können. In Europa sind bei Menschen überwiegend Babesia divergens zu finden. Nach dem Infektionsschutzgesetz (IfSG) wurden die letzten beiden Fälle von viralem hämorrhagischem Fieber durch das Krim-Kongo-Fieber-Virus (CCHFV) 2009 an das Robert Koch-Institut (RKI) gemeldet. Das CCHFV gehört zu den hochpathogenen Krankheitserregern (HCID), hierunter fallen etwa auch das SARS-CoV, Yersina pestis und Bacillus anthracis.
Neuroborreliose
Epidemiologie und Erreger
Die Borreliose zählt zu den häufigsten durch Zecken übertragenen Infektionskrankheiten in Europa. Sie wird durch Bakterien der Gattung Borrelia burgdorferi sensu lato Komplex B verursacht. Zu diesem Komplex gehören Borrelia burgdorferi, spielmanii, garinii und afzelii. Mehr als 30 Borrelienarten sind bekannt, in Deutschland bis zu sieben. Für einige Bundesländer besteht eine Meldepflicht, die sich hinsichtlich der Meldedaten unterscheidet: In Mecklenburg-Vorpommern meldet die Ärzt:in eine Borreliose ohne nähere Spezifikation. In Berlin, Brandenburg, Sachsen und Thüringen müssen nur Erkrankung und Tod angegeben werden. In Bayern, Rheinland-Pfalz und Saarland erfolgt eine Meldung bei definiertem borreliosespezifischem Krankheitsbild wie Erythema migrans, akuter Neuroborreliose oder akuter Lyme-Arthritis. Anhand der Meldedaten schätzt man die jährliche Inzidenz der Borreliose auf 26 – 41/100.000 – mit höheren Zahlen in Endemiegebieten.
Ein Erythema migrans ist in 80 – 90 % die häufigste Manifestation einer Borreliose (Stadium 1, vgl. Tabelle 1). Tage und Wochen nach dem Zeckenstich breitet sich die Wanderröte teils noch erheblich aus. In 10 – 30 % der Fälle geht sie mit unspezifischen Allgemeinsymptomen einher. Im Anschluss an die lokale Infektion kann es zu einer disseminierten Borrelieninfektion kommen. Die Manifestation wird in die Stadien der frühen (Stadium 2) und der späten disseminierten Neuroborreliose (Stadium 3) eingeteilt. Zur Unterscheidung dient die Symptomdauer von mehr als sechs Monaten. Der Verlauf einer Neuroborreliose ist variabel, auch muss sie nicht alle Stadien der Reihe nach durchlaufen. Das typische Bild einer Polyradikulitis ist die häufigste Manifestation einer frühen Neuroborreliose bei Erwachsenen, geprägt von teils plötzlich beginnenden, über Wochen persistierenden radikulär oder segmental betonten Schmerzen. Bei Kindern wird am häufigsten eine isolierte Meningitis ohne Symptome einer Radikulitis beobachtet. Die Symptomatik einer chronischen Neuroborreliose entwickelt sich über Monate bis Jahre.
Diagnose und Therapie
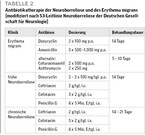
Entscheidend für die Diagnosesicherung ist die Liquordiagnostik. Im Liquor finden sich typischerweise eine lymphozytäre Pleozytose, erhöhtes Gesamteiweiß, eine Blutliquorschrankenstörung sowie eine intrathekale Immunglobulinsynthese. Serologisch finden sich borrelienspezifische IgM-Antikörper ab der dritten Woche und IgG-Antikörper ab der sechsten Woche. Beweisend für eine Neuroborreliose ist der spezifische Antikörperindex (ASI). Zunächst sollte ein ELISA durchgeführt werden, anschließend ein Western-Blot zur sicheren Diagnose. Bei leitliniengerechter antibiotischer Behandlung erholen sich die Patient:innen in der Regel rasch und vollständig. Die Antibiotikatherapie zeigt Tabelle 2. Die meisten Patient:innen haben eine gute Prognose und erholen sich rasch und vollständig.
Frühsommer-Meningoenzephalitis
Epidemiologie und Erreger
Das Frühsommer-Meningoenzephalitis-Virus (FSME-V) gehört zur Familie der Flaviviridae sowie zur Gattung der Arboviren und wird in drei Subtypen unterteilt (westlich, östlich, fernöstlich). Morphologisch gleicht das FSME-V dem Gelbfiebervirus, die Übertragung erfolgt durch Zecken (Ixodida). Bei der sogenannten Blutmahlzeit werden die im Speichel vorkommenden Viren auf den Wirt übertragen. Dabei kann die Zecke aber auch Krankheitserreger aufnehmen und somit ebenfalls als Wirt fungieren. Zunächst findet die Vermehrung des FSME-V lokal in Endothelzellen, Makrophagen, Langerhans-Zellen und Granulozyten statt. Die Ausbreitung des Erregers über das lymphatische System ins Blut bezeichnet man als erste Virämie. Die weitere Vermehrung im retikulo-endothelialen System beschreibt die zweite Virämie. Das FSME-V kann von dort aus über das Gefäßendothel oder durch Infektion von freien, mobilen Zellen (z. B. Makrophagen, dendritischen Zellen) in das ZNS gelangen.
Der Holzbock (Ixodes ricinus) ist der häufigste Überträger des FSME-V in Westeuropa, in Osteuropa die Taigazecke (Ixodes persulcatus). Als weiterer Überträger des FSME-V wird seit 2017 die Auwaldzecke (Dermacentor reticulatus) vermutet. Bei der FSME handelt es sich um eine saisonale Erkrankung von März bis Oktober mit Erkrankungsgipfel von April bis Juli. Das saisonale Auftreten würde sich durch die Auwaldzecke als potenzieller Überträger verschieben, wozu die milden Winter in Deutschland beitragen könnten. Die häufigste Übertragung des FSME-V erfolgt durch Zecken (oder infizierte Rohmilch).
Nach einer durchschnittlichen Inkubationszeit von zehn Tagen (5 – 28 Tage) beginnt die Erkrankung in circa 70 % der Fälle mit unspezifischen grippalen Symptomen (Sommergrippe) wie Fieber, Kopfschmerzen, katarrhalischen und gastrointestinalen Beschwerden. Serologie und Liquor sind zu diesem Zeitpunkt häufig noch unauffällig. Zu einem erneuten Fieberanstieg kommt es nach kurzzeitiger Besserung der Beschwerden, die sich in der Hälfte der Fälle als Meningitis, in etwa 40 % als Meningoenzephalitis und in circa 10 % als Meningoenzephalomyelitis manifestieren. Die reine Meningitis unterscheidet sich nicht wesentlich von anderen viralen Meningitiden, häufig ist das Allgemeinbefinden stärker beeinträchtigt, die Kopfschmerzen sind sehr intensiv und das Fieber ist ausgeprägter.
Das Bild der Meningoenzephalitis ist sehr variabel. Das Spektrum reicht von fokalneurologischen Symptomen wie Ataxie, Lähmungen von Extremitäten und Hirnnerven sowie Bewusstseinsstörungen bis zum Delir. Auch symptomatische epileptische Anfälle können auftreten. Häufiger zeigt die Meningoenzephalitis zerebelläre oder zentral okuläre Symptome. Primär manifestiert sich die Meningoenzephalomyelitis im Bereich der Vorderhörner des Rückenmarks und geht mit schlaffen Lähmungen einher. Häufig begleitet die Meningoenzephalomyelitis eine Hirnstammenzephalitis, weshalb sich meist auch Schluck- und Sprachstörungen, Lähmungen der Gesichts- und Halsmuskulatur sowie Atemlähmungen zeigen.
Die Meningoenzephalitis kann mit schweren Akutverläufen einhergehen, die ein Guillain-Barré-ähnliches Bild auslösen und eine spezialisierte neurologische intensivmedizinische Behandlung benötigen. In der Regel heilen sie verzögert aus. Reine Meningitiden verlaufen dagegen gutartig. Mit zunehmendem Alter bleiben vermehrt Defizite zurück und der Verlauf ist schwerer. 2018 wurde erstmals von einer Epilepsia partialis continua nach einer Infektion mit dem europäischen Subtyp berichtet. Die Letalität der FSME variiert innerhalb Europas von 1,5 bis 3,6 %. In 10 bis 30 % der Fälle treten bei Kindern grippeähnliche Symptome mit Fieber, Kopfschmerzen und Erbrechen auf, bei 6 – 10 % kommt es nach einem symptomfreien Intervall zu zentralnervösen Zeichen mit Apathie, Koma oder Krampfanfällen.
Bei Kindern ist der Verlauf einer Meningitis oft unkompliziert. Selten kommt es zu Doppelinfektionen mit FSME-V und Borrelia burgdorferi s.l. mit schwerwiegenden Verläufen. Erhebliche Beeinträchtigung des Allgemeinbefindens, hohes Fieber, Kopfschmerzen, Gleichgewichtsstörungen, qualitative und quantitative Bewusstseinsstörungen, Lähmungen von Hirnnerven, Armen und Beinen, häufig mit Muskelatrophien und Zittern der Gesichtsmuskeln und der Extremitäten, sind typische Symptome einer FSME.
Diagnose und Therapie
Die Diagnose wird bei Verdacht durch den Liquor gestellt. Hier zeigen sich eine Pleozytose sowie ein erregerspezifischer Antikörperindex (AI). Im Blut finden sich meist eine Leukozytose, eine Beschleunigung der Blutsenkungsgeschwindigkeit und/oder ein erhöhtes CRP. Die FSME wird letztlich durch den spezifischen Antikörperindex (ASI) im Liquor diagnostiziert, der spätestens vier Wochen nach Symptombeginn positiv ist. Eine stattgehabte Infektion mit dem Virus lässt sich serologisch durch IgG- und IgM-Antikörper nachweisen. Etwa zwei bis vier Wochen nach einem Zeckenstich finden sich zunächst spezifische IgM-Antikörper, ein bis zwei Wochen danach spezifische IgG-Antikörper. Aufgrund der hohen Verwandtschaft zu anderen Flaviviren sind hier Kreuzreaktionen zu beachten, es können isolierte oder nur leicht erhöhte IgM-Antikörper zu finden sein.
Eine signifikante Erhöhung der IgM-Antikörper während der akuten Erkrankungsphase kann diagnostisch ein wertvoller Hinweis sein, sie gelten aber nicht als Beweis für eine Infektion. Nach ein bis vier Wochen sollte eine erneute Bestimmung der IgG-Antikörper erfolgen. Bei einer Immundefekten-Suppression lassen sich keine IgM-Antikörper nachweisen. Hier kann man den signifikanten Konzentrationsanstieg von IgG-Antikörpern zwei Wochen nach Symptombeginn, die Bestimmung der intrathekalen Synthese spezifischer IgG-Antikörper im Liquor, den RNA-Nachweis mittels Liquor-PCR oder die Bestimmung der Avidität von IgG-Antikörpern heranziehen. Die Liquor-PCR ist meist nur in der Frühphase der Erkrankung nützlich, falls noch keine Antikörper nachweisbar sind und keine Pleozytose im Liquor vorhanden ist. Durchgemachtes Dengue-Fieber, Gelbfieber und Japanische Enzephalitis sowie der Zustand nach einer Infektion mit diesen und weiteren Flaviviren als auch vorherige Impfungen gegen FSME erschweren die Interpretation der nachweisbaren IgM-/IgG-Antikörper gegen FSME-V. Der Nachweis der intrathekalen Synthese von IgG-Antikörpern im Liquor oder von Antikörpern gegen das nicht strukturelle Protein 1 (NS1) im Serum kann in solchen Fällen hilfreich sein.
- Konsiliarlaboratorium für Frühsommer-Meningoenzephalitis (FSME), Robert Koch-Institut, Berlin
- Nationales Referenzlabor für durch Zecken übertragene Krankheiten (NRL-ZüK), Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit, Standort Jena
Eine kausale Therapie gibt es nicht, behandelt werden die grippeartigen Symptome. Bei einem schweren Verlauf ist eine spezialisierte neurologische intensivmedizinische Behandlung obligat und prognoseentscheidend. Die Prognose ist abhängig von Alter und Vorerkrankungen. Meningoenzephaloradikulitis (MER)-Patient:innen sind schwerer betroffen als Patient:innen mit einer isolierten Meningitis oder einer Meningoenzephalitis. Eine MER erfordert eine intensivmedizinische Behandlung mit maschineller Beatmung. Als Risikofaktor für eine MER gilt der Diabetes mellitus. In einer Studie zur Langzeitprognose wurde das männliche Geschlecht als Risikofaktor für einen schwerwiegenden Verlauf identifiziert. Kinder haben eine deutlich günstigere Prognose als Erwachsene, mit zunehmendem Alter verschlechtert sich diese jedoch. Eine isolierte Meningitis manifestiert sich in 50 % der Fälle, bei 40 % eine Meningoenzephalitis, bei 10 % eine Myelitis. Reine Meningitiden verlaufen meist gutartig, bei der Meningoenzephalitis kann es zu schweren Akutverläufen kommen, die eine intensivmedizinische Behandlung, gegebenenfalls mit maschineller Beatmung, erfordern. Normalerweise heilt die FSME verzögert gut aus.
Die Letalität einer FSME liegt bei weniger als 3,6 % in der Gruppe der über 50-Jährigen, bei einer meningoenzephalomyelitischen Manifestation macht sie 30 % aus. Gerade die "Golden Agers", die häufig ihre Freizeit draußen verbringen, sind stark gefährdet: 90 % der Erkrankungsfälle werden in der Freizeit erworben. Nach Paragraph 7 IfSG gehört die FSME zu den meldepflichtigen Erkrankungen: Jeden direkten oder indirekten serologischen Nachweis eines FSME-V muss das Labor namentlich melden.
- Die im Jahr 2019 erstmals in Deutschland gesichteten Hyalomma-Zecken können u. a. das gefährliche Krim-Kongo-Hämorrhagische Fieber übertragen.
- Die Borreliose verläuft in drei Stadien, die nicht alle und nicht der Reihe nach durchlaufen werden müssen.
- Für die Diagnose einer Borreliose und einer FSME ist die Liquoruntersuchung entscheidend.
- Die FSME beginnt meist mit unspezifischen grippalen Symptomen, später manifestiert sich eine Meningitis, eine Meningoenzephalitis oder Meningoenzephalomyelitis.
- Eine Borreliose wird antibiotisch behandelt, für die FSME gibt es keine kausale Therapie.
Interessenkonflikte: Die Autorinnen haben keine deklariert
Erschienen in: doctors|today, 2021; 1 (3) Seite 32-35