Blutbildveränderungen gehören zum ärztlichen Alltag – sowohl im Rahmen gezielter Diagnostik als auch bei Routinescreenings. Um zwischen harmlosen und behandlungsbedürftigen Krankheiten differenzieren zu können, sind neben anamnestischen Angaben in der Regel auch weiterführende Untersuchungen notwendig. Der nachfolgende Artikel soll eine Übersicht über die epidemiologischen Merkmale ausgewählter Blutbildveränderungen geben und zur Hilfestellung bei deren Abklärung dienen.
Eine problemorientierte und ausführliche Anamnese ist oft richtungsweisend. Hierbei gilt es, nach Symptom- und Befunddynamik, B-Symptomatik (Fieber > 38,5°C, Nachtschweiß, ungewollter Gewichtsverlust > 10 % des Körpergewichts in sechs Monaten), Allergien, Vorerkrankungen, Sozial- und Reiseanamnese, Tierkontakt sowie Medikamenteneinnahme/Noxenexposition zu fragen, um eine erste Differenzierung treffen zu können.
Rotes Blutbild
Die mit Abstand häufigste Veränderung ist eine Anämie. Dabei macht die Eisenmangelanämie (IDA; Iron Deficiency Anemia) mit mindestens 50 % der Fälle den Hauptanteil aus. An zweiter Stelle ist die Anämie der chronischen Erkrankung (ACD; Anemia of Chronic Disease) zu nennen, wobei keine eindeutigen epidemiologischen Zahlen zur Prävalenzrate vorliegen, da die ACD häufig in Kombination mit einer Eisenmangelanämie vorliegt und manchmal mit dieser verwechselt wird.
Die Eisenmangelanämie tritt mit einer Prävalenz von 5 – 10 % in der europäischen Bevölkerung auf. Die Ursachen dafür sind vielfältig. An erster Stelle steht der Blutverlust, sei es im Rahmen natürlicher physiologischer Prozesse wie der Regelblutung oder okkulter Blutungen, z. B. im Rahmen gastrointestinaler Erkrankungen. Erhöhter Eisenbedarf in der Schwangerschaft, im Wachstum oder bei sportlich aktiven Menschen sind weitere Gründe. Eine von fünf Frauen im gebärfähigen Alter leidet an einer Eisenmangelanämie und noch weit mehr an einem latenten Eisenmangel, der bei entsprechender Symptomatik bereits als behandlungsbedürftig gilt.
Auch eine verminderte Eisenaufnahme kommt als Ursache einer IDA infrage, wobei hier zwischen nutritiven Defizienzen und Resorptionsstörungen unterschieden wird. Aufgrund der westlichen, fleischreichen Ernährung sind nutritive Ursachen eher selten. Bei den Resorptionsstörungen kommen Zöliakie, atrophische oder Helicobacter-pylori-positive Gastritiden, chronische Therapie mit Protonenpumpeninhibitoren oder Zustand nach bariatrischen Operationen infrage.
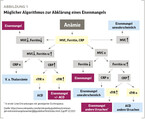
Von einer IDA abgegrenzt werden müssen die ebenfalls hypochromen, mikrozytären Thalassämien, bei denen zumeist eine Erythrozytose besteht, sowie die Anämie der chronischen Erkrankung. Die häufigsten Ursachen sind hierbei Autoimmunerkrankungen, chronisch-entzündliche Darmerkrankungen, chronische Hepatopathien, Malignome und Infektionskrankheiten. Es liegt kein klassischer Eisenmangel, sondern eine funktionelle Eisenverwertungsstörung vor. Es kommt zu einer Eisenrestriktion durch Induktion von Hepcidin, welches den einzigen Eisenexporteur Ferroportin hemmt – so verbleibt das Eisen intrazellulär und steht nicht zur Hämatopoese zur Verfügung. Laborchemisch ist die ACD durch hohes Ferritin als Ausdruck gefüllter Eisenspeicher, jedoch mit normalen Werten des löslichen Transferrinrezeptors (sTfR) gekennzeichnet. Wenn der lösliche Transferrinrezeptor trotz erhöhten Ferritins hochreguliert ist, spricht dies für eine Eisenmangelanämie (Abb.1).
Die Anämie ist meist nur Symptom des eigentlichen pathologischen Geschehens. Daher ist die Bestimmung des Kausalnexus für die Therapieentscheidung essenziell. Im Rahmen der Auswertung des roten Blutbildes als Mittel zur ursächlichen Abklärung einer Anämie gilt das Interesse hier zunächst den Retikulozyten als Vorstufe der roten Blutkörperchen sowie Volumen der Erythrozyten (MCV) und Hämoglobingehalt der Erythrozyten (MCH).
Bei der Analyse der Retikulozytenzahlen weisen erhöhte Werte auf eine adäquate Nachbildung im Rahmen einer Blutung oder Hämolyse hin. Erniedrigte Zahlen deuten auf einen Nährstoffmangel oder eine Bildungsstörung hin. Betrachten wir die Dimensionen der Zellgröße und Farbreaktion, so legen mikrozytäre, hypochrome Zellen den Verdacht auf einen Eisenmangel nahe. Makrozytäre, hyperchrome Zellen hingegen lassen eher an einen Mangel an Vitamin B12 oder Folsäure denken. Eine Makrozytose findet sich außerdem beim myelodysplastischen Syndrom (MDS), Alkoholismus oder Leberzirrhose und entwickelt sich häufig auch regenerativ nach dem Start einer Eisensubstitutionstherapie. Bei Verdacht auf eine renale Ursache einer normochromen, normozytären Anämie ist die Bestimmung des Erythropoetinspiegels angezeigt, wobei dieser meist vermindert ist. Eine Erhöhung gibt hingegen Hinweis auf eine Knochenmarkinsuffizienz. Bei normochromen, normozytären Anämien sollte neben der Basisdiagnostik eine Immunfixation aus dem Serum und Harn vorgenommen und Immunglobuline, Schilddrüsenwerte, Kortisol und antinukleäre Antikörper bestimmt werden. Bei Anämien mit Verdacht auf Blutung oder Malignom ist eine gynäkologische, gastroenterologische beziehungsweise weiterführend bildgebende Abklärung indiziert
Weißes Blutbild
Bei der Beurteilung der Leukozyten und des Differenzialblutbilds sollten immer Absolutwerte herangezogen werden. Bei erstmaligem Auftreten einer isolierten Neutropenie > 1.000/µL ohne vermehrte Infekte und mit unauffälliger Anamnese können vorerst engmaschige Kontrollen erfolgen. Häufig sind Neutropenien reaktiv im Rahmen von Virusinfektionen zu beobachten. Gelegentlich werden sie durch Arzneimittel, Autoimmunerkrankungen oder seltener Knochenmarkinfiltration bei malignen Erkrankungen hervorgerufen. Desweiteren sollte bei Menschen mit afrikanischer oder nahöstlicher Abstammung an eine benigne ethnische Neutropenie (BEN) gedacht werden.
Eine sehr häufige Konstellation ist eine Erhöhung der Leukozyten und Nikotinabusus. In den meisten Fällen handelt es sich um asymptomatische Patient:innen mit Leukozytenwerten zwischen 10.000 und 20.000/µL ohne das Vorhandensein einer Lymphozytose oder Basophilie. Die restlichen Blutwerte rangieren ebenfalls zumeist in der Norm, jedoch zeigt sich oft eine zusätzliche Erhöhung des C-reaktiven Proteins (CRP).
Eine Leukozytose mit Linksverschiebung liegt dann vor, wenn vermehrt granulozytäre Vorstufenzellen im peripheren Blut detektierbar sind, d. h. Stabkernige, Metamyelozyten, Myelozyten, Promyelozyten bis hin zu Blasten. Ein solches "buntes Blutbild" in Verbindung mit einer neutrophilen Leukozytose gibt Hinweise auf das Vorliegen einer chronisch myeloischen Leukämie (CML) und bedarf spezieller Abklärung. Wenn es zum Fehlen von mittleren Reifungsstadien der Granulopoese und einer Vermehrung von undifferenzierten Blasten kommt (leukämische Lücke; "Hiatus leucaemicus"), liegt der Verdacht einer akuten myeloischen Leukämie nahe und erfordert umgehende Kontaktaufnahme mit einem Zentrum. Die AML ist mit über 80% die häufigste Form der akuten Leukämien im Erwachsenenalter mit einer jährlichen Inzidenz von 3,5/100.000. Das Erkrankungsrisiko steigt ab dem 65. Lebensjahr deutlich an und gilt im Gegensatz zur akuten lymphatischen Leukämie (ALL) als eine Erkrankung des älteren Menschen.
Bei einer Lymphozytose >5000/µL sollte eine Leukozytentypisierung veranlasst werden. Die chronisch lymphatische Leukämie (CLL), definitionsgemäß ein indolentes B-Zell-Lymphom, geht mit einer Inzidenz von 4:100.000 pro Jahr einher und ist somit die häufigste chronische Leukämieform. Patient:innen mit CLL ohne Therapiebedarf kann zunächst eine "Watchful-waiting-Strategie" verfolgt werden. Die Notwendigkeit einer Therapie ergibt sich bei Zunahme der Zytopenien (Hb < 10 g/dl, Thrombozyten < 100.000/µL), B-Symptomatik, progredienter oder symptomatischer Lymphadenopathie bzw. Splenomegalie, rasch progredienter Lymphozytose (Lymphozytenverdoppelungszeit < 6 Monate oder Anstieg um 50% in 2 Monaten bei einem Ausgangswert von mindestens 30.000/µL) sowie refraktären Autoimmunzytopenien oder schwerwiegender Fatique.
Thrombozytosen und Polyglobulien können mit myeloproliferativen, aber auch chronisch-entzündlichen bzw. malignen Erkrankungen einhergehen. Über 80 % der Thrombozytosen sind reaktiv bedingt, d.h. im Rahmen von Operationen, Traumata, bei Eisenmangel, Blutungen oder Malignomen. Eine isolierte Polyglobulie kann sich außerdem bei kardialer oder respiratorischer Insuffizienz, Rauchen, Schlaf-Apnoe-Syndrom, Testosterontherapie, Missbrauch von androgenen, anabolen Steroiden oder durch Erythropoese-stimulierende Substanzen entwickeln. Insbesondere bei stattgehabten thromboembolischen Ereignissen, Kopfschmerzen und/oder Sehstörungen ist eine weitere Abklärung indiziert
Thrombozytopenien treten häufig auf im Rahmen von Schwangerschaften, Autoimmunerkrankungen oder Virusinfektionen auf, selten werden sie durch Heparin induziert (HIT) oder sind toxisch bedingt. In 12,5% der Fälle sind erniedrigte Werte durch eine EDTA-Pseudothrombozytopenie erklärbar und eine Bestimmung aus dem Zitratblut ist angezeigt. Seltenere Ursachen sind Immunthrombozytopenien, thrombotische Mikroangiopathien oder Leukämien.
Beachte: Als weiterführende Diagnostik hämatologischer Erkrankungen sind die sonographische Bestimmung der Milzgröße sowie des peripheren Lymphknotenstatus, die Knochenmarkbiopsie inkl. molekularbiologischer und zytogenetischer Untersuchungen bzw. die Lymphknotenexstirpation zu nennen. Das weitere Prozedere ergibt sich unter Berücksichtigung des körperlichen Befunds, der Krankengeschichte und der laborchemischen und histologischen Ergebnisse.
In der Regel lassen sich mit einer gezielten Basisdiagnostik Patient:innen mit temporären Blutbildveränderungen von kritisch Kranken mit akut kompromittierenden Ursachen unterscheiden, bei denen akuter Handlungsbedarf besteht und eine umgehende Kontaktaufnahme mit einem Spezialzentrum angezeigt ist. Warnzeichen sind rasch progrediente Symptomatik oder zusätzlich zur Anämie vorliegende laborchemische Parameter wie Thrombozytopenie, Leukozytopenie oder Leukozytose, Fragmentozyten, LDH-Erhöhung, erhöhte Nierenretentionsparameter und Bilirubin sowie erniedrigtes Haptoglobin als Ausdruck einer Hämolyse, hohes Ferritin oder auch eine Organomegalie (Hepato- oder Splenomegalie) (Abb. 2).
Im besten Fall führt die Abklärung zu einer Arbeitsdiagnose, die eine adäquate Behandlung nach sich zieht. In vielen Fällen handelt es sich jedoch um passagere, reaktive Blutbildveränderungen. Hämatoonkologische Systemerkrankungen sind sehr selten, bedürfen jedoch unverzüglicher Abklärung und Versorgung in einem spezialisierten Zentrum.
- Die häufigste Blutbildveränderung ist die Anämie, dominierende Ursache ist der Eisenmangel.
- Bei der Beurteilung des weißen Blutbilds sollten immer Absolutzahlen herangezogen werden.
- Hämatoonkologische Systemerkrankungen sind selten.
Erschienen in: doctors|today, 2022; 2 (4) Seite 44-47