Mit opportunistischen Infektionen ist auch im Zeitalter effektiver antiretroviraler Therapien zu rechnen. Die Erstmanifestationen einer bis dahin unerkannten und/oder nicht behandelten HIV-assoziierten Immunschwächeerkrankung sind meist lebensbedrohliche Infektionen. Der Hausarzt sollte daher Leitsymptome sowie diagnostisches und therapeutisches Vorgehen kennen. Die vorliegende Arbeit beschreibt die wichtigsten opportunistischen Infektionen durch Pneumocystis jiroveci, Candida species, Toxoplasma gondii und Zytomegalievirus.
Die Infektion mit dem Humanen Immundefizienz-Virus (HIV) ist unbehandelt durch einen fortschreitenden Verlust der zellvermittelten Immunabwehr gekennzeichnet [11]. In der Folge entstehen opportunistische Infektionen (OI). OI sind neu erworbene oder reaktivierte Infektionen durch meist ubiquitäre oder persistierende Keime.
Die Interaktion zwischen HIV und OI ist jedoch wechselseitig. So können OI andererseits zu einem reversiblen Anstieg der Viruslast (VL) führen [13].
Durch Unterdrückung von VL und durch den Anstieg CD4-positiver T-Lymphozyten reduziert eine antiretrovirale Therapie (ART) das Risiko einer HIV-assoziierten OI. So haben zahlreiche Studien den dramatischen Rückgang der Inzidenz HIV-assoziierter OI bei Kohorten mit Zugang zu einer effektiven ART gezeigt [12].
Die Inzidenzen der OI, die mit einer massiven Immunschwäche assoziiert sind, wie zum Beispiel Zytomegalievirus (CMV)-Erkrankungen, sind heute, verglichen mit Mitte der 90er-Jahre, auf weniger als ein Zehntel zurückgegangen [4, 5].
Symptome der chronischen HIV-Infektion manifestieren sich meist als unspezifische Störungen. Verläufe und Krankheitsbilder sind individuell und unterschiedlich. Eine klinische Symptomatik kann gefolgt sein von Phasen völliger oder weitgehender Beschwerdefreiheit. Andererseits können sich die Komplikationen, die durch einen schweren Immundefekt bedingt sind, auch aus scheinbar völliger Gesundheit akut entwickeln. Diese schweren Manifestationen entsprechen dann dem "Acquired Immune Deficiency Syndrome" (Stadium AIDS) der HIV-Infektion. In den ersten beiden Jahren nach HIV-Infektion ist der Anteil der mit AIDS Erkrankten gering, danach erkranken jährlich etwa 6 % der HIV-Infizierten.
AIDS manifestiert sich in der überwiegenden Zahl (in 70 %) der bis dahin unerkannten bzw. nicht antiretroviral behandelten Fälle in Form lebensbedrohlicher opportunistischer Infektionen bei "Late Presentern". Die bedeutsamsten OI sind Pneumonien durch Pneumocystis jiroveci (PjP), Ösophagitiden durch Candida albicans, durch Toxoplasmen verursachte zerebrale Abszesse und Reaktivierungen von Zytomegalievirus-Infektionen mit Manifestationen in unterschiedlichen Endorganen wie Auge, Lunge, Hirn und Darm [15].
Pneumocystis-jiroveci-Pneumonie
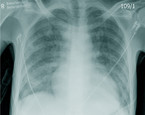
Eine der häufigsten OI, bei etwa 45 % der primären AIDS-Manifestationen, ist die PjP [10]. Ursächlich ist eine speziesspezifische Pilzart. Typisch für die PjP sind subakuter Beginn, subfebrile Temperaturen, trockener Reizhusten und eine langsam progrediente Belastungsdyspnoe bei respiratorischer Partialinsuffizienz, oft begleitet von Mundsoor und Gewichtsverlust. Die Bildgebung im Röntgen des Thorax kann initial noch unauffällig sein, die interstitiellen Infiltrate werden im Computertomogramm besser dargestellt. Daher kann die Erkrankung zunächst lange unerkannt bleiben.
Diagnostisch ist der rasche Erregernachweis mittels bronchoalveolärer Lavage anzustreben (Sensitivität > 90 %) bei Ausschluss oder Nachweis von Koinfektionen wie Zytomegalievirus oder bakterieller Infektion einschließlich Mykobakterien. Der Beginn der Behandlung sollte nicht aus diagnostischen Gründen verzögert werden, denn Pneumozysten sind auch bis zu zehn Tage nach Therapiebeginn noch nachweisbar.
Therapie der Wahl ist Trimethoprim-Sulfamethoxazol über 21 Tage, bei protrahiertem Verlauf auch länger. Initial wird zusätzlich Prednison oder Prednisolon über 5 bis 10 Tage gegeben. Nur leichte Formen der Erkrankung können per os und ambulant behandelt werden. An die Akuttherapie schließt sich eine Sekundärprophylaxe mit Trimethoprim-Sulfamethoxazol an.
Candidiasis von Oropharynx und Ösophagus
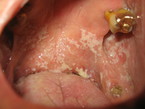
Die oropharyngeale Candidose (OC) als häufigste OI ist eine Blickdiagnose (Abb. 3). Ursächlich für die weißlichen, abstreifbaren Beläge ist überwiegend Candida albicans. Die Soor-Ösophagitis als AIDS-definierende Erkrankung ist assoziiert mit Dysphagie und retrosternalen Schmerzen, in etwa 70 % der Fälle besteht begleitend eine OC. Bei Mundsoor und typischer Klinik ist eine Endoskopie zunächst nicht notwendig.
Therapie der Wahl bei OC und Soor-Ösophagitis ist Fluconazol, am ersten Behandlungstag in der doppelten therapeutischen Dosis als "loading dose", bei ausgeprägter Dysphagie initial intravenös. Bei Befundpersistenz nach 14 Tagen ist eine mikrobiologische Erregerdiagnostik einschließlich Resistenzbestimmung bzw. bei Verdacht auf Ösophagitis eine endoskopische Untersuchung angebracht. Nach Beginn einer ART ist mit der Beherrschung auch multiresistenter Candida-Stämme zu rechnen [10].
Zerebrale Toxoplasmose
Die zerebrale Toxoplasmose ist die wichtigste neurologische OI bei HIV-Patienten in Europa [1] und wird in Deutschland nach RKI-Meldungen in etwa 10 % der AIDS-definierenden OI diagnostiziert [10]. Kennzeichnend sind ein akuter Beginn der Symptome, Fieber, Cephalgie, Sensibilitätsstörungen und fokal-neurologische Symptome. Bei Patienten mit diesem Symptomenkomplex sollte eine HIV-Infektion serologisch ausgeschlossen werden.
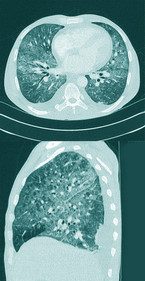
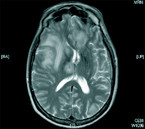
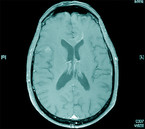
Der parasitäre Erreger – Toxoplasma gondii – persistiert in Gewebszysten, Endwirte sind Katzen, die umweltresistente Oozysten ausscheiden. Nach einer aktuellen seroepidemiologischen Studie des RKI sind in der BRD unabhängige Risikofaktoren für eine positive Toxoplasmose-Serologie männliches Geschlecht, Katzenhaltung, ein Body-Mass-Index von 30 kg/m2 oder mehr sowie Wohnen in ländlichen Regionen; dagegen sind negativ assoziiert eine vegetarische Ernährung und ein hoher sozioökonomischer Status [21]. Für Menschen mit stark kompromittiertem Immunsystem kann eine Neuinfektion durch Aufnahme von Oozysten, zum Beispiel durch ungewaschenes Gemüse oder durch eine Reaktivierung von Gewebszysten, letale Folgen haben [16]. Diagnostisch ist eine MRT des Schädels mit intravenöser Kontrastmittelgabe zielführend (Abb. 4 und 5).
Therapie der Wahl ist Pyrimethamin, kombiniert mit Sulfadiazin oder Clindamycin sowie Folinsäure wegen der Myelotoxizität von Pyrimethamin. Bei ausgeprägtem Hirnödem oder Hirndruck ist zusätzlich Dexamethason, zeitlich begrenzt wegen der Aspergillose-Gefahr, indiziert. Nach mindestens 4 bis 6 Wochen Akuttherapie und einer Rückbildung der Läsionen um mindestens 50 % können die Dosierungen zur Erhaltungstherapie halbiert werden [19], alternativ kann auch mit Cotrimoxazol 960 mg, einmal täglich, weiterbehandelt werden. Da Clindamycin die intakte Hirnschranke nicht passiert, wird es in der Erhaltungstherapie nicht empfohlen [10].
Das Absetzen der Erhaltungstherapie ist bei einem Anstieg der CD4-T-Lymphozyten auf > 200/µl über mindestens 3 bis 6 Monate möglich. Eine medikamentöse Primärprophylaxe ist bei Helferzell-Zahlen < 200/µl [7] angebracht. IgG-Negative sollten Gemüse gut waschen und kein kurz gebratenes oder rohes Fleisch essen (Expositionsprophylaxe) [10].
Zytomegalievirus-Infektionen
Risikofaktoren für eine CMV-Infektion sind weibliches Geschlecht, Alter, ein niedriger sozioökonomischer Status und eine schlechte Immunität [6, 9].
In einem Circulus vitiosus verstärkt eine primäre oder reaktivierte CMV-Infektion die Immunsuppression und damit den Ausbruch weiterer OI [2, 3, 20]. Bei nicht antiretroviral behandelten Patienten mit Helferzellzahlen von weniger als 50/µl ist bei fieberhafter CMV-Virämie die Retinitis in etwa 25 % der Fälle die häufigste Organmanifestation [18]. Eine akute Sehstörung erfordert eine umgehende augenärztliche Untersuchung und einen sofortigen Therapiebeginn.
In der Prä-ART-Ära war die nicht blutige Diarrhoe bei 10 % der Patienten Ausdruck einer Enterokolitis mit multiplen Schleimhautläsionen. Manifestationen eines Endorganschadens bei fieberhafter Virämie können jedes Organ betreffen und ebenso eine Enzephalitis, Pneumonie oder Ösophagus-Ulzera verursachen.
Mittel der Wahl ist Valganciclovir 450 mg täglich, 2-0-2, ein oral gut resorbierbares, myelotoxisches Prodrug von Ganciclovir. Bei visusbedrohender Retinitis muss mit Ganciclovir oder Foscavir intravenös behandelt werden. Eine alleinige intraokuläre Behandlung verhindert nicht die Dissemination der Erkrankung. Die Induktionstherapie sollte über mindestens drei Wochen und bis zur Abheilung der Läsionen gegeben werden, dann kann auf die Erhaltungstherapie (Sekundärprophylaxe), entsprechend der Hälfte der Dosierung, übergegangen werden. Extraokuläre Manifestationen werden analog zur CMV-Retinitis behandelt. Die Therapie wird klinisch und anhand der CMV-Virämie überwacht. Bei mangelndem Therapieerfolg ist eine genotypische Resistenztestung möglich und sinnvoll [10, 17].
Ein Ende der Erhaltungstherapie ist frühestens nach 6 Monaten und einem Anstieg der CD4-positiven T-Lymphozyten auf 100 – 150/µl möglich [10].
Opportunistische Infektionen: Wann mit der ART beginnen?
Bei Candidosen spricht nichts gegen einen sofortigen Beginn der ART [10].
Bei einem unmittelbaren Beginn der ART nach Diagnosestellung einer CMV-Retinitis droht eine Visusverschlechterung infolge eines Immunrekonstitutionssyndroms (IRIS) [8], dagegen könnte ein verzögerter ART-Beginn zu weiteren OI-Ereignissen führen. Daher sollte die ART nicht später als zwei Wochen nach Beginn der CMV-Therapie begonnen werden [10].
Ein ART-Beginn innerhalb der ersten beiden Wochen nach Beginn der Therapie der OI ist aus gleichen Gründen auch für die PjP sinnvoll [10] und nach Therapiestart bei zerebraler Toxoplasmose sollte die ART ebenfalls so rasch wie möglich [7] bzw. innerhalb von zwei bis drei Wochen nach Diagnose initiiert werden [14].
Interessenkonflikte: Der Autor erhält Vortragshonorare von der Bristol-Meyers Squibb GmbH & Co. KGaA, von Gilead Sciences GmbH und der Hexal AG.
Erschienen in: Der Allgemeinarzt, 2017; 39 (3) Seite 52-56