Die Prävalenz chronischer Nierenerkrankungen nimmt weltweit zu. Um eine gute Behandlungsprognose zu erreichen, ist eine frühzeitige Diagnose wichtig. In diesem Zusammenhang kommt den behandelnden Hausärzt:innen eine besondere Bedeutung zu. Ihre Aufgabe ist es, Risikopatient:innen zu identifizieren und ggf. die Diagnose einer chronischen Nierenerkrankung zu stellen. Geeignete Screening-Tests sind die geschätzte glomeruläre Filtrationsrate und die Albuminausscheidung im Urin. Im folgenden Artikel werden die Möglichkeiten der hausärztlichen Diagnostik und die Situationen, in denen eine Überweisung zum Nephrologennotwendig wird, näher beleuchtet.
Eine chronische Nierenkrankheit (Chronic Kidney Disease, CKD) wird nach der internationalen Organisation KDIGO (Kidney Disease: Improving Global Outcomes) als eine Anomalie der Nierenstruktur oder Nierenfunktion definiert, die über einen Zeitraum von mehr als drei Monaten anhält. Die CKD geht u. a. mit einer verminderten glomerulären Filtrationsrate (GFR) und/oder einer erhöhten Albuminausscheidung im Urin einher [1]. Das zur Klassifikation der CKD verwendete CGA-Schema setzt sich aus den Aspekten Cause (Ursache), geschätzte GFR (eGFR) und Albuminurie zusammen [2]. Um eine CKD zu diagnostizieren, muss mindestens eines der folgenden Merkmale vorliegen:
- GFR unter 60 ml/min/1,73 m2 (Serumkreatinin)
- Albuminurie (Albumin im Urin ≥ 30 mg/l pro 24 Stunden oder Albumin-Kreatinin-Verhältnis (UACR) ≥ 30 mg/g)
- Anomalien, die auf eine Nierenfunktionsstörung hindeuten und durch Histologie und Bildgebung nachweisbar sind
- Störungen der Nierentubuli oder
- Nierentransplantation in der Vorgeschichte [1]
KDIGO ist eine internationale unabhängige Organisation, deren Ziel es ist, evidenzbasierte Leitlinien zum Thema CKD weltweit zu publizieren und zu implementieren [3]. Dazu hat KDIGO ein Schema zur Einteilung der CKD veröffentlicht (Abb. 1), anhand dessen das kardiovaskuläre und renale Risiko (Komorbiditäten, Komplikationen und Mortalität) durch die Kombination aus eGFR- und Albuminurie-Kategorien abgeleitet werden kann [1]. So sollten Serumkreatinin und Albumin im Urin im Abstand von drei Monaten wiederholt gemessen werden. Das Stadium der CKD wird dabei anhand der Kategorien G1 – G5 der eGFR und der Kategorien A1 – A3 der Albuminurie ermittelt (Abb. 1).
Zu den häufigsten Risikofaktoren für eine CKD zählen Rauchen, Diabetes, Hypertonie und Adipositas. Auch Erkrankungen wie beispielsweise chronische Glomerulonephritis, chronische Pyelonephritis, Autoimmunkrankheiten, polyzystische Nierenkrankheit oder angeborene Fehlbildungen der Nieren sowie die chronische Einnahme von entzündungshemmenden Medikamenten (NSAID) begünstigen das Auftreten einer CKD [4 – 6]. Man unterscheidet beeinflussbare (z. B. Hypertonie, Ausmaß der Hyperglykämie, Albuminausscheidungsrate, Übergewicht) von nicht beeinflussbaren Faktoren(ethnische Herkunft, Alter oder Geschlecht) [7].
Im Jahr 2016 wurde in einer repräsentativen Schätzung für Deutschland eine CKD-Prävalenz von 12,7 % ermittelt, was etwa 10 Millionen Menschen entspricht, die an CKD in allen Stadien der Erkrankung leiden [8]. Während die CKD 2016 weltweit noch Platz 16 bei Ursachen für verlorene Lebensjahre belegte, sagen Prognosen für das Jahr 2040 bereits einen Anstieg auf Platz 5 voraus [9]. Da die Nierenfunktion allgemein im Alter abnimmt, kommt es auch infolge des demografischen Wandels zu einem Anstieg der Häufigkeit der CKD [10, 11]. Zudem steigt auch die Anzahl der Patient:innen mit Risikofaktoren für eine CKD. Mit der zunehmenden Verbesserung der Therapie und Prognose von z. B. kardiovaskulären Erkrankungen überleben Patient:innen immer länger und haben entsprechend mehr Lebenszeit, eine manifeste Nierenkrankheit auszubilden. Darüber hinaus belegen Studien, dass ein starker Zusammenhang zwischen einer CKD, kardiovaskulären Erkrankungen (CVD), Krankenhauseinweisungen sowie erhöhtem Sterberisiko besteht [12, 13].
Meist verlaufen frühe Stadien einer CKD symptomarm, weshalb Betroffene häufig keine Kenntnis von ihrer Nierenkrankheit haben [11]. Dies steigert die Wahrscheinlichkeit, dass eine CKD in einem frühen Stadium unerkannt bleibt und folglich nicht therapiert wird [14]. In Deutschland befassen sich unter anderem die Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e.V. (DEGAM) und die Deutsche Gesellschaft für Nephrologie (DGfN) mit der CKD. Die DEGAM hat 2019 in ihrer Leitlinie zur Versorgung von Patient:innen mit nichtdialysepflichtiger Nierenerkrankung Handlungsempfehlungen zur Anwendung in den Hausarztpraxen veröffentlicht [15]. Ein Ziel ist es, vor allem Risikogruppen regelmäßig durch geeignete Screeningverfahren zu untersuchen, um Nierenkrankheiten frühzeitig erkennen zu können. Damit soll eine entsprechende Therapie ermöglicht werden, um schwere Krankheitsverläufe möglichst zu verhindern [14].
Praxisempfehlung: Die Anzahl an Patient:innen in der hausärztlichen Praxis, die an einer CKD erkrankt sind, nimmt kontinuierlich zu. Dies beruht auch auf einer zunehmend alternden Bevölkerung und einem Anstieg der Volkskrankheiten wie Adipositas, Diabetes und Hypertonie. Wichtig ist es, die Diagnose frühzeitig zu stellen, um den Krankheitsverlauf zu verlangsamen und eine optimale Therapie einzuleiten.
Screening: Wer, wann und wie?
Zur Bestimmung der Nierenfunktion wird die GFR in der Regel anhand endogener Filtrationsmarker geschätzt. Der gängigste Biomarker ist Kreatinin [16]. Die Serumkreatinin-Konzentration wird von der GFR und anderen physiologischen Prozessen beeinflusst, einschließlich Kreatinin-Bildung durch Muskeln und Nahrungsaufnahme [17]. Um die eGFR mittels Kreatinin-Bestimmung zu schätzen, wurde seit Anfang des Jahrtausends vor allem die MDRD-Formel (Modification of Diet in Renal Disease) genutzt [18]. Neuere Leitlinien empfehlen dagegen seit etwa 10 Jahren die Berechnung der eGFR anhand der sogenannten CKD-EPI-Formel (Chronic Kidney Disease Epidemiology Collaboration) [4, 11]. Allerdings müssen hierbei Alter, Geschlecht, Muskelmasse, Ethnizität sowie die Ernährung der Patient:innen berücksichtigt werden [11, 19]. Mittlerweile wird daher nach einem alternativen Biomarker geforscht [20]. So wird der Biomarker Cystatin C bei besonderen Personengruppen wie in der Pädiatrie oder Geriatrie eingesetzt oder um nicht eindeutige eGFR-Testergebnisse zu verifizieren. Die Bestimmung von Cystatin C ist jedoch vergleichsweise kostspielig und eignet sich daher nicht als Standardprozedere in der Hausarztpraxis [11].
Der Referenzstandard für die Messung des Proteinverlustes im Urin ist eine zeitlich begrenzte 24-Stunden-Urinsammlung von Albumin [21]. Ein erstes Screening auf Proteinurie erfolgt meist mittels Urin-Teststreifen. In einer Spontanurinprobe werden Kreatinin sowie Albumin gemessen und als Albumin-Kreatinin-Ratio (UACR) in mg/g ausgedrückt. Die Teststreifen haben eine hohe Sensitivität für das Vorhandensein einer Makroalbuminurie (UACR > 300 mg/g) [22]. Vielen Teststreifen fehlt allerdings zum einen die Sensitivität für Mikroalbuminurie und zum anderen sind die Tests oft falsch positiv, z.B. bei konzentriertem oder stark alkalischem Urin, oder auch nach starker körperlicher Anstrengung [23].
Praxisempfehlung: Anhand der Ergebnisse aus der Blut- und Urinuntersuchung lässt sich ein Verhältnis zwischen Albumin und Kreatinin berechnen, die sogenannte Albumin-Kreatinin-Ratio (UACR). Die UACR ermöglicht in der Hausarztpraxis die Vermeidung einer aufwendigen und fehleranfälligen Eiweißquantifizierung im 24-h-Sammelurin.
Im Rahmen der Nationalen Versorgungsleitlinie (NVL) "Nierenerkrankungen bei Diabetes im Erwachsenenalter", die derzeit (Stand 07/2022) überarbeitet wird, wurde die Rolle der behandelnden Hausärzte beim CKD-Screening genauer definiert. Zum Thema Screening besagt die NVL, Menschen mit T1DM fünf Jahre nach Diagnosestellung und Menschen mit T2DM bei klinischer Diagnosestellung auf eine Mikroalbuminurie zu testen. Die UACR soll dabei mittels Teststreifen im Morgenurin bestimmt werden [7]. Der Normbereich des Albumins liegt bei Werten bis zu 30 mg/g [11]. Sind zwei aufeinanderfolgende Proben identisch im Ergebnis, sprich positiv-positiv oder negativ-negativ, lässt sich eine Albuminurie beweisen oder ausschließen. Bei unterschiedlichen Ergebnissen erfolgt eine dritte Probe [7]. Weiter empfiehlt die NVL, die eGFR zur Ersteinschätzung zu nutzen [7].
Im Zuge der "Klug entscheiden"-Initiative der Deutschen Gesellschaft für Innere Medizin (DGIM) hat die DGfN Empfehlungen ausgesprochen, welche Patient:innen zu einer Risikogruppe zählen. Explizit wurden hierbei die Erkrankungen Diabetes und arterielle Hypertonie genannt [10]. Die DEGAM empfiehlt laut ihrer S3-Leitlinie "Versorgung von Patienten mit chronischer nicht-dialysepflichtiger Nierenerkrankung in der Hausarztpraxis" ein Screening bei Risikogruppen [15]. Einmal jährlich soll daher die eGFR bei Patient:innen mit einer bekannten Diabeteserkrankung bestimmt werden. Hierbei wird nicht zwischen T1DM und T2DM unterschieden. Weiter empfiehlt die Leitlinie für Patienten mit neu aufgetretener Hypertonie, den Urin auf eine Proteinurie oder Albuminurie zu testen und das Serumkreatinin und die eGFR zu bestimmen. Bei Patienten, die nephrotoxische Medikamente einnehmen, unterscheidet die DEGAM-Leitlinie zwischen temporärer und dauerhafter Einnahme. Bei einer zeitlich begrenzten Einnahme soll die Bestimmung der eGFR vor und nach Abschluss der Behandlung erwogen werden, wohingegen bei einer dauerhaften Einnahme dieNierenfunktion mindestens einmal jährlich überprüft werden sollte [15]. Bei auffälligem Screening in Blut-, Serum- oder Urinuntersuchung sollte eine weiterführende Diagnostik erfolgen.
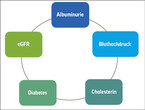
Praxisempfehlung: Um Risikopatient:innen in der hausärztlichen Praxis frühzeitig zu erkennen, kann eine vereinfachte Risikoabschätzung anhand der ABCDE-Regel (Albuminurie, Hypertonie, Cholesterin bzw. kardiovaskuläre Vorerkrankungen, Diabetes und eGFR (Abb. 2) durchgeführt werden[13]. Kommt es bei einem oder mehreren Punkten zu Auffälligkeiten, ist ein tiefergehendes Screening indiziert.
Anamnese, körperliche Untersuchung und weiterführende Diagnostik
Für die Evaluierung der Ursache einer CKD wird neben der persönlichen auch eine Familienanamnese erstellt. Im Rahmen der Anamneseerhebung werden Vorerkrankungen und bisherige sowie akut interkurrente Medikamenteneinnahmen abgefragt [11]. Auch gilt es Auffälligkeiten bei der Miktion auszuschließen, beispielsweise Blut im Urin, schäumenden Urin (bei Proteinurie), eine Polyurie oder Anurie. Anschließend wird eine körperliche Untersuchung durch den behandelndenArzt durchgeführt. Neben der Erfassung der Vitalparameter (Blutdruck, Herzfrequenz, Atemfrequenz, Körpertemperatur) muss der intra- und extravaskuläre Volumenstatus sowie die Haut überprüft werden. Hier liegt der Fokus vor allem auf Ödemen, Exanthemen oder Ulcera. Zum Abschluss wird die Patient:in auf neurologische und kardiologische Anhaltspunkte untersucht [11]. Neben labormedizinischer Diagnostik und körperlicher Untersuchung sollten Patient:innen mit einer CKD oder einem hohen Risikoprofil für eine CKD bildgebenden Verfahren unterzogen werden, insbesondere Ultraschalluntersuchungen, um mögliche Anomalien der Nieren frühzeitig feststellen zu können [4, 15].
Überweisung zur Fachärzt:in
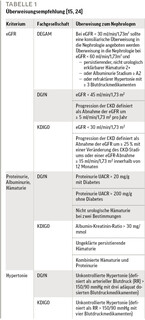
Dazu werden die in Tabelle 1 dargestellten Empfehlungen von verschiedenen Fachgesellschaften gegeben. Die DEGAM empfiehlt zudem bei jüngeren Patient:innen unter 50 Jahren, die Indikation zur Überweisung großzügiger zu stellen. Bei Patient:innen über 70 Jahren hingegen sollten Faktoren wie Komorbidität, Lebenserwartung und individuelle Gesundheitsziele berücksichtigt werden [25].
Praxisempfehlung: Zur genaueren Diagnostik einer CKD können in der hausärztlichen Praxis eine Urinprobe sowie eine Blutabnahme für eine Labordiagnostik stattfinden und bildgebende Verfahren sowie eine umfangreiche körperliche Untersuchung erfolgen. Bei der Entscheidung, ob eine Überweisung zum Nephrologen sinnvoll ist, helfen die Leitlinien der DEGAM, der DGfN und der KDIGO (Tabelle 1).
FAZIT
Eine CKD lässt sich durch einfache Maßnahmen, wie einen Urintest, frühzeitig erkennen und behandeln. In Abb. 3 werden alle vorgestellten Schritte zusammengefasst, die im hausärztlichen Bereich erfolgen sollten. Grundsätzlich lässt sich sagen, dass bei raschen Verschlechterungen der Laborparameter, auch oftmals ohne erkennbaren Grund, oder in höhergradigen Stadien der CKD (z. B. eGFR < 45 ml/min/1,73m2) eine Betreuung durch den Nephrologen indiziert ist.
- Hausärzt:innen sollten Risikokandidaten für eine CKD identifizieren.
- Für das Screening spielen eGFR und Albuminurie eine zentrale Rolle.
- Leitlinien helfen bei der Entscheidung zur Überweisung.
Danksagung: Die Autoren danken Ronja Stohmann und Martin Miszon, Sciarc GmbH, Baierbrunn, für die Unterstützung bei der Erstellung des Manuskripts.
Prof. Dr. Jan Galle
Erschienen in: doctors|today, 2022; 2 (11) Seite 38-42