Um einen plötzlichen Herztod (PHT) verhindern zu können, stehen eine Reihe primärprophylaktischer Therapieverfahren zur Verfügung. Je nach Risikokonstellation sind dies medikamentöse Optionen wie Antiarrhythmika oder Herzinsuffizienzmedikamente, eine Defibrillatortherapie oder eine Katheterablation. Im Folgenden sollen einige Aspekte dieser Therapien sowie die Aussagekraft verschiedener Screeningmethoden beleuchtet werden.
Der plötzliche Herztod (PHT) ist ursächlich für ca. 30% der kardiovaskulären Todesursachen in Deutschland; im Jahr 2014 verstarben 65.000 Menschen am plötzlichen Herztod [1]. EKG-Untersuchungen aus den 90er-Jahren in den Niederlanden zeigen, dass bei 58% der Patient:innen bei prähospitalen Reanimationen eine Kammertachykardie oder Kammerflimmern vorlag und zu 42% eine Bradykardie/Asystolie [2]. Die meisten ventrikulären Tachyarrhythmieepisoden spielen sich auf dem Boden einer strukturellen Herzerkrankung ab, meist einer ischämischen Herzerkrankung/koronaren Herzerkrankung (KHK) [3]. Zudem gibt es einen Altersgipfel von median 70 Jahren und männliche Patienten scheinen mit 70 – 80% stärker betroffen zu sein [1]. Ein kleiner Teil der Überlebenden eines Ereignisses des plötzlichen Herztods (PHT), ca. 10%, weist ein strukturell unauffälliges Herz auf und hat eine hereditäre Arrhythmie.
Sekundärprävention des plötzlichen Herztodes
Da dieser Artikel sich hauptsächlich mit der Prädiktion und (Primär-)Prävention des PHT befasst, soll dieser Aspekt nur kurz beleuchtet werden. Zur Sekundärprophylaxe des PHT steht die Defibrillatortherapie, auch bekräftigt in der neuen Leitlinienempfehlung der Europäischen Gesellschaft für Kardiologie (ESC), mit einer Klasse-IA-Empfehlung zur Verfügung [4]. Eine definitive Defibrillatortherapie kann mit implantiertem transvenösem Defibrillator (ICD) erfolgen oder mit subkutanem Defibrillator (S-ICD). Dieser kann für junge Patienten, die potenziell einen Großteil ihres Lebens mit Defibrillator verbringen werden, im Hinblick auf Revisionsoperationen, Batteriewechsel und mögliche Infektionsrisiken sinnvoll sein. Allerdings weist der extrakardiale S-ICD eine reine Schockfunktion auf, die Möglichkeit zur antibradykarden oder antitachykarden Stimulation besteht nicht. Dementsprechend gilt für dieses Gerät eine Klasse-IIa-B-Empfehlung [4] für ein ausgewähltes Patientenkollektiv.
Merke: Patient:innen mit Z. n. überlebtem PHT sollten mit ICD versorgt werden.
Primärprävention des plötzlichen Herztodes
Patient:innen nach akutem Myokardinfarkt oder mit ischämischer Kardiomyopathie, die 6 – 12 Wochen nach Therapie- bzw. Diagnosestellung und Initiierung einer medikamentösen Herzinsuffizienztherapie eine hochgradig eingeschränkte linksventrikuläre Pumpfunktion (LVEF) ≤ 35 % aufweisen, haben ein erhöhtes Risiko für ventrikuläre Tachyarrhythmien. In den frühen Postinfarktstudien der 90er-Jahre (u.a. MADIT-II Studie) konnte ein signifikanter Überlebensvorteil der mit ICD geschützten Patientenverzeichnet werden mit einer relativen Risikoreduktion (RRR) von 33% im Vergleich zur konventionell medikamentösen Therapie [5]. Daher besteht eine Klasse-I-Indikation zur Defibrillatortherapie, wenn die Patientenzusätzlich Herzinsuffizienzsymptome entsprechend NYHA-Klasse II–III aufweisen [4]. Für Patient:innen ohne Herzinsuffizienzsymptome besteht eine Klasse-IIa-Empfehlung [4].
Merke: Patient:innen mit ischämischer Kardiomyopathie und LVEF ≤ 35 % sowie NYHA II/III-Symptomatik haben ein erhöhtes PHT-Risiko und eine Klasse-I-Empfehlung zur ICD-Implantation
Medikamentöse Herzinsuffizienztherapie/nicht-antiarrhythmische Therapie
Blickt man auf die letzten fast 30 Jahre Herzinsuffizienztherapie zurück, so zeigt sich ein deutlich regredientes Mortalitätsrisiko durch die mittlerweile optimierten Therapieverfahren sowohl in der Devicetherapie (Defibrillator, kardiale Resynchronisationstherapie), aber auch in der medikamentösen Therapie [6]. Eine 2017 publizierte Studie, die 40.195 Patient:innen evaluierte, die in 12 Herzinsuffizienzstudien in einem Zeitraum von 19 Jahren eingeschlossen worden waren, ergab eine Abnahme des Risikos des PHT (unter optimaler Therapie) von 44% [6]. Insbesondere der kardioprotektive Effekt in Verbindung mit Anti-Remodeling durch die Inhibition des Renin-Angiotensin-Aldosteron-Systems (RAAS) ist hier von großer Bedeutung. Die RALES-Studie konnte eine Abnahme des kardial-arrhythmogenen Todes unter Spironolactontherapie von 29% verzeichnen [7], eine Subgruppenanalyse der PARADIGM-HF-Studie bezifferte diesen Effekt für ARNI auf 20% RRR [8]. Für SGLT-2-Inhibitoren besteht zumindest bei Patientenmit Typ-2-Diabetes ein antiarrhythmischer Effekt im Hinblick auf die Reduktion von atrialen und ventrikulären Arrhythmien [9]. Die Betablockertherapie ist in der Primär- und Sekundärprävention des PHT mit einer RRR von > 40% elementar und nach wie vor die effektivste medikamentöse Therapie [10, 11].
Die Meilensteinstudien der ICD-Therapie wurden hauptsächlich in den 90er-Jahren/Anfang 2000er publiziert und in den letzten Jahren wissenschaftlich diskutiert. Es gibt Hinweise darauf, dass Patienten mit primärprophylaktischer ICD-Indikation, bei denen ausschließlich eine niedrige LVEF ≤ 35% als Implantationskriterium herangezogen wurde (auf dem Boden der zuletzt gültigen ESC-Leitlinie von 2015), selten lebensrettende ICD-Schocks erfahren haben [17]. Zudem sind diese Patient:innen potenziell letalen Komplikationen wie Materialversagen (Sondenbrüche, Batteriedefekte, Rückrufaktionen, Infektionen) ausgesetzt [18]. Daher scheint eine hochgradig eingeschränkte LVEF als alleiniges Risikostratifikationstool inadäquat zu sein.
Merke: Eine optimale Herzinsuffizienztherapie mit RAAS-Blockade, Beta-Blockade und SGLT-2- Inhibition kann das PHT-Risiko senken.
Primärprävention des plötzlichen Herztodes bei Patient:innen mit nichtischämischer Herzerkrankung
Die DANISH-Studie konnte als erste Studie bei 1.116 Patient:innen mit symptomatischer Herzinsuffizienz auf dem Boden einer nichtischämischen Kardiomyopathie (NICM) und LVEF ≤ 35% zeigen, dass eine primärprophylaktische ICD-Implantation bei Patienten mit optimaler Herzinsuffizienztherapie (u. a. 60% kardialer Resynchronisationstherapie, CRT) keinen Überlebensvorteil erbrachte [12]. Allerdings scheint ein altersabhängiger Unterschied zu bestehen, da jüngere Patient:innen (< 65 Jahre) durch die Defibrillatorfunktion einen signifikanten Überlebensvorteil aufwiesen [12]. Dennoch zog diese Studie in die aktuelle Leitlinienempfehlung ein und die Empfehlung zur primärprophylaktischen ICD-Implantation bei NICM-Patient:innen mit NYHA-II–III-Herzinsuffizienzsymptomatik wurde auf eine Klasse-IIa-Empfehlung herabgesetzt [4]. Vielmehr wurde betont, dass bei genau diesen Patient:innen die Grunderkrankung und das potenziell arrhythmogene Substrat genauer zu definieren seien, beispielsweise durch Herz-MRT-Untersuchungen, genetische Testung und elektrophysiologische Untersuchungen, und in der Zusammenschau der Risikofaktoren entsprechend entschieden werden sollte [4].
Merke: Nach neuer ESC-Leitlinie besteht für symptomatische Patient:innen mit NICM und LVEF ≤ 35% eine Klasse-IIa-Empfehlung zur ICD-Implantation.
Wie kann der Hochrisikopatientfür einen plötzlichen Herztod identifiziert werden?
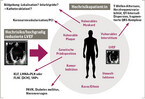
Eine Vielzahl von elektrophysiologischen Arbeitsgruppen befasst sich mit dieser Fragestellung, so auch unsere Gruppe. Sicher ist, dass eine hochgradig eingeschränkte LVEF – obwohl sie allein als Risikostratifikationstool schwach ist – einen unabhängigen Risikomarker für das Erleiden eines kardial-arrhythmogenen Herztodes darstellt. Daher sollte der klinische Ansatz sein, eine hochgradig eingeschränkte LVEF mit Hochrisikopatient:innen in Einklang zu bringen (vgl. Abb. 1). Als Risikomarker dient beispielsweise eine vulnerable Plaque in den Koronararterien, die mit PCI kurativ behandelt werden könnte. Weiterhin könnte vulnerables Myokard mit nichtinvasiven bildgebenden Verfahren wie der Herz-MRT-Untersuchung dargestellt werden. Die Präsenz von "late gadolinium enhancement" (LGE), der späten Kontrastmittelaufnahme, kann Hinweis für inflammatorisch verändertes Myokard sein oder für Myokardnarben, die somit lokalisiert werden können und ggf. therapeutisch auch mit Katheterablation modifiziert und "elektrisch ausgeschaltet" werden können. Zudem kann das vulnerable Interstitium mittels EKG, Ergometrie und Langzeit-EKG-Diagnostik relativ genau charakterisiert werden. Risikomarker im Langzeit-EKG wie T-Wellen-Alternans, Herzfrequenzvariabilität, QT-Intervall-Dispersion oder die Präsenz eines fragmentierten QRS-Komplexes im Ruhe-EKG zeigten sich in Untersuchungen als prognostisch relevant. Zudem sollte bei familiärer Prädisposition/positiver Familienanamnese für ein Ereignis des PHT unbedingt eine genetische Untersuchung bei entsprechend strukturell verändertem Herzen oder eindeutig auffälligen EKG-Befunden erwogen werden. In Zusammenschau dieser Risikofaktoren UND in Gegenwart einer eingeschränkten LVEF kann ein Hochrisikopatient mit ICD-Therapie, medikamentöser Therapie und/oder Katheterablation effektiv vor dem PHT geschützt werden. Allerdings kann es auch sein, dass Patient:innen mit Hochrisiko-LV-Funktion relevante Komorbiditäten wie periphere arterielle Verschlusskrankheit, terminale Nierenerkrankung mit Dialysepflicht oder Diabetes mellitus aufweisen. Bei jungen Patient:innen können dies zusätzliche Risikofaktoren für den PHT darstellen [13]; bei hochbetagten Patient:innen sollte der Nutzen einer ICD-Implantation in dieser Konstellation ggf. kritisch erwogen werden.
Merke: Es gibt diverse Risikomarker, die das individuelle PHT-Risiko in Zusammenschau mit einer eingeschränkten LVEF genauer definieren können.
Zukunftsmusik: Könnte ein PHT kurzfristig vorhergesagt werden?
Risikomarker, die auf lange Sicht ein Ereignis des PHT ggf. vorhersagen können, wurden nun ausführlich diskutiert. In der Oregon Unexpected Death Study zeigte sich, dass 50% der Middle-Agers Warnsymptome vor dem letalen Ereignis hatten. Sinnigerweise wiesen jene ein sechsfach besseres Überleben auf, die aufgrund dieser Symptome einen Notruf absetzten [14]. Auch zeigten Untersuchungen aus unseren Arbeitsgruppen, dass in einer weiblichen Population von Myokardinfarktüberlebenden, geschützt mit tragbarem Defibrillator (WCD), die Aktivität – gemessen in täglicher Schrittzahl – im Schnitt 16 Tage vor Erleiden eines rettenden WCD-Schocks signifikant abnahm [15]. Zudem konnten wir feststellen, dass Patientinnen vor WCD-Schockabgabe schon eine Woche zuvor deutlich höhere nächtliche Herzfrequenzen hatten als Patientinnen, die keinen WCD-Schock erleiden [16].
So erhoffen wir uns in Zukunft mit Hilfe der sogenannten "Wearables" (Smartwatches, Smartphone-Apps, WCD etc.) und unter Benutzung von "Big Data" weitere Erkenntnisse zu gewinnen, um den PHT besser vorhersagen und verhindern zu können.
- Ein plötzlicher Herztod (PHT) entsteht in 58% der Fälle auf dem Boden einer ventrikulären Tachyarrhythmie.
- Bei einer LVEF ≤ 35% nach Myokardinfarkt oder Kardiomyopathie ist das Risiko erhöht.
- Als Primärprävention kommt u. a. ein ICD infrage.
Julia W. Erath
Erschienen in: doctors|today, 2023; 3 (2) Seite 14-17