Wenn man von einer Erkrankung sagt, dass sie alle Organsysteme betreffen kann, fordert das unser ärztliches Vorstellungsvermögen heraus und kann eine Diagnose schwierig machen. Grundsätzlich kann sich ein systemischer Lupus erythematodes (SLE) sehr unterschiedlich präsentieren. Zum Glück ist die Realität aber meist nicht gar so kompliziert. Das lernt man auch aus der Entwicklung der neuen Klassifikationskriterien.
Für die Diagnose eines SLE sind die Klassifikationskriterien der European League Against Rheumatism (EULAR) und des American College of Rheumatology (ACR) [1] nicht gedacht. Viele Elemente helfen dennoch im Diagnoseprozess.
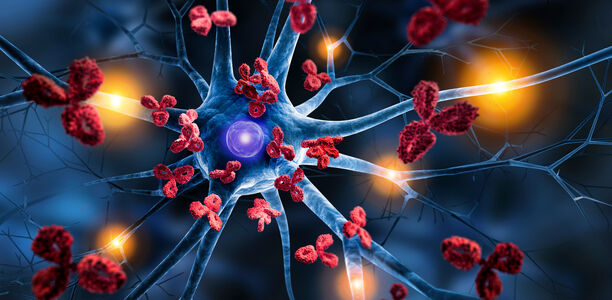
Was passiert beim SLE überhaupt? Im Wesentlichen sind alle Manifestationen die Folge von Autoantikörpern [2]. Zum Teil wirken diese Antikörper direkt auf Zellen. Das gilt zum Beispiel für die Coombs-positive hämolytische Anämie, bei der die Autoantikörperbeladung zur Zerstörung der Erythrozyten führt. Der Großteil der Manifestationen ist aber Folge von Immunkomplexen, Aggregaten aus Autoantikörpern und Autoantigenen, die zur Komplementaktivierung, zur Bindung durch Abwehrzellen über Fc-Rezeptoren und über die Produktion von Zytokinen letztlich zur Entzündung führen. Beispiele dafür sind Immunkomplexe aus doppelsträngiger DNA (dsDNA) und Anti-dsDNA-Antikörpern an der Basalmembran der Glomeruli, die zur proliferativen Lupusnephritis führen, und Ro-Anti-Ro-Immunkomplexean der Basalmembran der Haut als Ursache girlandenförmiger Rötungen der Haut (subakut kutaner Lupus erythematodes).
Wenn SLE-Patient:innen über ihre Symptome zum Zeitpunkt der SLE-Diagnose und kurz davor Auskunft geben, kommen viele relativ unspezifische Allgemeinsymptome vor. Im Rahmen der Entwicklung der EULAR/ACR-Kriterien haben sich 339 SLE-Patientinnen und Patienten aus der Lupus erythematodes Selbsthilfegemeinschaft e.V. über ihre Quartalszeitschrift "Schmetterling" anonym an einer Fragebogenstudie beteiligt [3]. Fast 90 % berichteten über eine bleischwere Müdigkeit (Fatigue), die am ehesten an das erinnert, was wir fast alle kurz vor Ausbruch einer Grippe kennen, und über schmerzende Gelenke (Arthralgien) – noch ein Symptom, das an Virusinfekte erinnert. Drei Viertel hatten Myalgien und etwa die Hälfte Fieber. Im Gegensatz zum Virusinfekt halten diese Symptome aber an. Dazu kamen bei fast zwei Dritteln Hautausschläge, bei fast der Hälfte Haarverlust, bei einem Drittel Beinödeme und bei etwa einem Viertel atemabhängige Thoraxschmerzen.
Wenn man die Manifestationen ärztlich objektiviert und Patient:innen mit frühem SLE mit einer Kontrollgruppe mit anderen, dem SLE ähnlich sehenden Erkrankungen vergleicht, wird klarer, welche Symptome tatsächlich SLE-typisch sind. In der Früh-SLE-Kohorte der EULAR/ACR-Kriterien [4] waren das nicht die Fatigue und auch nicht die Arthralgien, wohl aber Fieber, SLE-Hautausschläge, nichtvernarbende Alopezie und Schleimhautulzera, geschwollene Gelenke (Arthritis) und Rippenfell- und Herzbeutelentzündung.
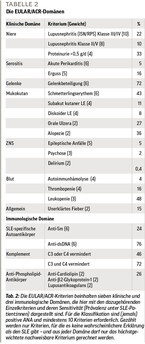
Die EULAR/ACR-Kriterien für den SLE beinhalten insgesamt sieben klinische Domänen (Tabelle 2) mitbis zu fünf Einzelkriterien pro Domäne. Dabei zählt auch die Hämatologie als klinische Domäne. Für die Klassifikation sind (jemals) positive antinukleäre Antikörper (ANA) als Eingangskriterium erforderlich, die eine sehr hohe Sensitivität (99,5 %) haben, aber nicht spezifisch sind (Spezifität 19,4 %). Ist das erfüllt und ein klinisches Kriterium positiv, reichen für die Klassifikation zehn Punkte, wobei aber aus jeder Domäne nur ein Kriterium (das mit der höchsten Punktzahl) gezählt werden darf.
Für die Klassifikation ist ein Grundsatz entscheidend: Kein Kriterium darf gewertet werden, wenn es dafür eine wahrscheinlichere Erklärung als den SLE gibt. Fieber wird nur gewertet, wenn eine Infektion weitestgehend ausgeschlossen wurde (und das CRP nicht deutlich erhöht ist). Die Arthritis zählt nicht, wenn gleichzeitig die Anti-CCP-Antikörper der doch viel häufigeren rheumatoiden Arthritis nachweisbar sind. Und in vielen Fällen wird zum Beispiel eine Rosazea als Schmetterlingserythem fehlgedeutet.
Die Prozentsätze in Tabelle 2 geben die Häufigkeit (Sensitivität) an, wie sie sich aus der kombinierten Entwicklungs- und Validierungskohorte der SLE-Kriterien mit fast 1.200 SLE-Patientinnen und Patienten errechnet [5]. Häufig sind die Gelenkbeteiligung, die Haut- und Schleimhautbeteiligung und die Leukopenie. Ziemlich genau ein Drittel aller SLE-Patientinnen und Patienten hat eine Lupusnephritis. Selten, wenn auch wichtig, sind die ZNS-Manifestationen (Tabelle 1). Neben den Kriterienmanifestationen gibt es noch eine große Zahl seltener Formen der Organbeteiligung (Tabelle 3), sowohl in den Kriteriendomänen (Haut, ZNS) als auch parenchymatös in Herz und Lunge und in anderen Organsystemen.
Eine weitere Frage wurde im Rahmen der Entwicklung der EULAR/ACR-Kriterien erstmals gestellt: Hängen manche der Kriterien typischerweise zusammen? Gibt es so etwas wie verschiedene SLE-Schubladen? Das wurde in der Früh-SLE-Studie und den Eurolupus-Daten im Detail untersucht [6]. Das Ergebnis war sehr interessant: Zwar gab es innerhalb der Organdomänen Assoziationen, also zum Beispiel zwischen verschiedenen Haut- und Schleimhaut-Manifestationen und verschiedenen hämatologischen Manifestationen. Das hat zur Wiedereinführung der Domänen geführt und zur oben erwähnten Regel, dass aus einer Domäne nur ein Kriterium gezählt werden darf. Über die Domänen hinaus gab es hingegen keine signifikanten Zusammenhänge. Das heißt, dass das Spektrum bei jedem einzelnen SLE-Patienten individuell ist.
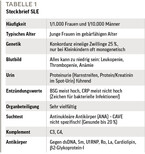
Was bedeutet das jetzt für den rationalen Umgang mit einer insgesamt doch seltenen Erkrankung? Aus meiner Sicht sollte daran gedacht werden, wenn zumindest eine der typischen klinischen SLE-Manifestationen vorliegt (Tabelle 1) und es dafür keine wahrscheinlichere Erklärung gibt. Nur dann sollten als Suchtest die ANA bestimmt werden. Sind diese klar positiv, sind weitere Schritte sinnvoll, auf jeden Fall Differenzialblutbild und Urinstreifen (einfacher Test auf Proteinurie) und dann die Antikörper-Subtypisierung und die Messung der Serum-Komplementkomponenten C3 und C4.
Die im Akronym SAV3E zusammenfassbaren Basismaßnahmen bei SLE beinhalten Sonnenschutz, Anti-Malariamittel (Hydroxychloroquin), Vitamin D, Ergänzen der Schutzimpfungen und Kontrolle vaskulärer Risikofaktoren – sowie die Evaluation der Organbeteiligung [7]. Nur relevante Organbeteiligungen müssen darüber hinaus behandelt werden.
- Ein Großteil der Manifestationen des SLE ist Folge von Immunkomplexen.
- Die Symptome sind zu Beginn oft unspezifisch.
- Typisch für SLE sind Fieber, Hautausschläge, Alopezie, Schleimhautulzera und Gelenkschwellungen.
Prof. Dr. Martin Aringer
Erschienen in: doctors|today, 2022; 2 (8) Seite 36-38