Wenn wir Diabetespatient:innen über die Gefahren des hohen Blutzuckers aufklären, kommen Komplikationen wie die diabetische Retinopathie, Nephropathie und Neuropathie zur Sprache. Gemäß verschiedenen epidemiologischen Studien besteht aber auch ein erhöhtes Parkinsonrisiko. Das soll hier näher erläutert werden.
Mit "Parkinson" ist hier das idiopathische Parkinsonsyndrom (iPS) gemeint – der eigentliche Morbus Parkinson. Das iPS entsteht schleichend über Jahre hinweg. Wesentlich ist ein Untergang von dopaminergen Neuronen [1], was dann zu den Kardinalsymptomen von allgemeiner Bradykinesie, Rigor und Ruhetremor führt. Aber das iPS besteht aus mehr als diesen motorischen Symptomen und macht sich schon Jahre vorher bemerkbar, was als prodromale Erkrankungsphase bezeichnet wird. Zu diesem Zeitpunkt hat der neurodegenerative Prozess bereits begonnen, klinisch sind die typischen iPS-Diagnosekriterien aber noch nicht vorhanden, das heißt, man findet noch keinen Tremor oder Rigor und keine Bradykinesie.
Einige nicht motorische Symptome und Komorbiditäten sowie Gewohnheiten sind mit einem höheren und andere mit einem niedrigeren Risiko assoziiert, Jahre später an einem iPS zu erkranken.
Die Movement Disorders Society (MDS) hat eine Übersicht mit prädiktiven Faktoren für ein zukünftiges iPS zusammengestellt. Protektiv sind beispielsweise Rauchen (!), Kaffeekonsum und/oder regelmäßige körperliche Aktivität. Risikofaktoren sind unter anderem männliches Geschlecht, positive Familienanamnese, höheres Alter und/oder eine Verhaltensstörung im REM-Schlaf [2] (vgl. Kasten). Schon lange gab es gewisse Hinweise, dass eine diabetische Stoffwechsellage das Parkinsonrisiko erhöhen oder damit assoziiert sein könnte [3]. Tatsächlich hat die MDS in einem Update einen Typ-2-Diabetes ebenfalls als Risikofaktor für ein späteres iPS eingestuft [4]. Diese Einschätzung basiert auf verschiedenen Kohortenstudien zu diesem Thema. Wenn hier von Diabetes mellitus (DM) die Rede ist, dann ist im Wesentlichen der Typ-2-Diabetes gemeint, selbst wenn viele Arbeiten aus methodischen Gründen keine strikte Abgrenzung zum Typ 1 vorgenommen haben.
Wie klar ist die Evidenz?
In einer aktuellen Metaanalyse konnte kein erhöhtes iPS-Risiko infolge eines DM nach Auswertung von sieben Fall-Kontroll-Studien festgestellt werden [5]. Allerdings zeigte sich in derselben Metaanalyse eindeutig ein erhöhtes iPS-Risiko in neun Kohortenuntersuchungen. Vermutlich kann die übliche Zuordnung von Kontrollpersonen, basierend auf Alter und Geschlecht, eine unbewusste Verzerrung durch weitere iPS-Risikofaktoren in Fall-Kontroll-Studien nicht ausgleichen, wie das sozusagen automatisch in den weitaus größeren Populationen von Kohortenstudien gegeben ist. In der genannten Metaanalyse waren in die Fall-Kontroll-Studien 26.654 Personen eingeschlossen, was nur ein Bruchteil ist im Vergleich zu den 3.819.006 Personen in den Kohortenstudien.
Die Autoren einer weiteren Metaanalyse kommen zu demselben Schluss [6]: kein erhöhtes iPS-Risiko gemäß Fall-Kontroll-Studien – aber klare Zunahme der OR um den Faktor 1,29 laut Untersuchungen an größeren Kohorten. Auch neuere Kohortenstudien, die in diesen Metaanalysen noch nicht berücksichtigt wurden, stützen die Annahme eines erhöhten iPS-Risikos infolge eines DM [7 – 9]. Anlass zur Sorge gibt die Feststellung, dass bereits Diabetesvorstufen das iPS-Risiko erhöhen können [7, 9].
Erhöhtes Parkinsonrisiko: Was tun?
Es gibt also genügend Hinweise, dass ein DM oder sogar eine DM-Vorstufe das Risiko für eine Parkinsonerkrankung erhöht. Zudem konnten Rhee et al. eindrücklich einen "Dosiseffekt" belegen mit einem deutlichen Anstieg des iPS-Risikos bei längerer versus kurzer Diabetesdauer beziehungsweise bei Personen mit einem erhöhten Nüchternblutzucker im Vergleich zu euglykämischen Personen [7].
Somit könnte potenziell viel erreicht werden, wenn vulnerable Personen durch ein entsprechendes Screening in der Grundversorgung frühzeitig erfasst würden und durch Lebensstilmodifikationen die Entwicklung einer (prä-)diabetischen Stoffwechsellage vermieden würde. Hervorzuheben ist, dass regelmäßige körperliche Aktivität vor Parkinson schützt und natürlich allen (prä-)diabetesgefährdeten Personen ebenso wie eine mediterrane Ernährung empfohlen wird [10, 11]. In der Arbeit von Sanchez-Gomez war hingegen unklar [9], ob mehr Jahre mit einem erhöhten HbA1c-Wert tatsächlich mehr Risiko bedeuten oder nicht. Und mangels prospektiver Interventionsstudien ist gegenwärtig unklar, ob überhaupt oder spätestens wann der neurodegenerative Prozess aufgehalten werden könnte.
- Der REM-Schlaf ist einerseits durch das Träumen und andererseits durch eine weitgehende Muskelatonie gekennzeichnet. Nur noch die Atemmuskulatur ist aktiv und es zeigen sich rasche Augenbewegungen (Rapid Eye Movements, REM).
- Bei der Verhaltensstörung im REM-Schlaf (auch REM-Parasomnie genannt) schreien die Betroffenen und schlagen um sich, weil sie Albträume ausleben. Die übliche Muskelatonie fehlt.
- Die REM-Parasomnie ist häufig ein prodromales Phänomen für ein idiopathisches Parkinsonsyndrom (iPS), das sich aber erst etliche Jahre später zeigen wird.
- Zur symptomatischen Therapie werden Melatoninpräparate oder Clonazepam (Rivotril®) empfohlen. Diese Substanzen sind nicht verlaufsmodulierend!
- Leider existieren noch keine etablierten Präventionsstrategien, was im ärztlichen Alltag ein Dilemma darstellt. Sollen die Betroffenen über ihr in Zukunft erhöhtes iPS-Risiko aufgeklärt werden?
- Eine Diabetesprävention könnte unter Umständen auch eine iPS-Prävention sein. Dafür wären Personen mit einer REM-Parasomnie eine ideale Zielgruppe.
Medikamentöse Maßnahmen
In einer Metaanalyse wird die Datenlage zusammengefasst, ob bestimmte Antidiabetika das zukünftige iPS-Risiko beeinflussen könnten [12]. Aus unterschiedlichen methodischen Gründen müssen die Schlussfolgerungen kritisch betrachtet werden, zum Beispiel durch die bereits erwähnte Möglichkeit unbewusster Verzerrung im Rahmen von Fall-Kontroll-Studien.
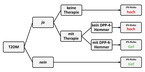
Nur eine der ausgewerteten Arbeiten hinterlässt einen wirklich robusten Eindruck: Brauer et al. analysierten anhand einer Datenbank der britischen Grundversorgung die Medikation von über 100.000 T2DM-Patient:innen in Relation zum iPS-Risiko in einer Verlaufsbeobachtung von median 3,33 Jahren [13]. Die iPS-Rate war 36 bis 60 % geringer mit Dipeptidylpeptidase-4-Inhibitoren (DPP-4-Hemmer) und GLP-1- Rezeptor-Agonisten (GLP-1-RA) im Vergleich zu anderen Antidiabetika. Weitere Analysen der Datenbank zeigten, dass das iPS-Risiko ohne T2DM-Diagnose am geringsten war und am höchsten bei unbehandeltem T2DM [14] (Tabelle 1, Abb. 1).
Das deutet auf ein "window of opportunity" hin, in dem das iPS-Risiko bei Typ-2-Diabetes gesenkt werden kann. Das könnte besonders für bis dahin unsportliche Männer mit einem T2DM und einer Verhaltensstörung im REM-Schlaf interessant sein (vgl. Kasten). Männliches Geschlecht, Bewegungsmangel und Verhaltensstörung im REM-Schlaf gehen per se mit einem höheren iPS-Risiko einher [2, 4, 10, 15]. Auf alle Fälle wäre es sinnvoll, die Entwicklung eines iPS auch als Endpunkt im Rahmen von Diabetesstudien nebst der Vermeidung von mikro- und makrovaskulären Komplikationen zu definieren.
Mutmaßliche Pathophysiologie
Welcher pathophysiologische Mechanismus steckt hinter der Assoziation von DM und iPS sowie hinter der protektiven Wirkung bestimmter Antidiabetika? Zunächst muss betont werden, dass sich ein iPS auch ohne DM entwickeln kann, dass also von einer multifaktoriellen Pathophysiologie auszugehen ist [4]. Die verschiedenen Übersichtsarbeiten zum Thema beschreiben hochkomplexe biochemische Vorgänge im ZNS und theoretische Vorstellungen im Rahmen einer diabetischen Stoffwechsellage [16], die im Praxisalltag nicht wirklich weiterhelfen. Aber fast alle basieren auf dem Konzept einer zerebralen Insulinresistenz, was somit klar den T2DM in den Fokus rückt. Insulin ist unter anderem ein neurotropher Faktor. Im Rahmen einer zerebralen Insulinresistenz ist diese neurotrophe Wirkung reduziert und es kommt zu einer (zusätzlichen) Schädigung der dopaminergen Neurone in der Substantia nigra, was dann eher zu einem iPS führen kann. Die Insulinresistenz ist aber potenziell reversibel, und hier scheint die Wirkung von DPP-4-Hemmern und GLP-1-RA vielversprechend – zumindest aus neurologischer Sicht.
Danksagung: Ein großes Dankeschön geht an Frau Dr. med. Constantine Bloch, Fachärztin für Allgemeine Innere Medizin und Infektiologie, für ihre wertvollen Kommentare zum Manuskriptentwurf.
Genehmigter und bearbeiteter Nachdruck aus Ars medici 24/2021
- Das Erkennen und das Betreuen von Personen mit einem erhöhten Diabetesrisiko sind zentrale Anliegen der Grundversorgung.
- Prädiabetes sowie Typ-2-Diabetes gehen gemäß epidemiologischer Studien mit einem erhöhten Risiko für ein idiopathisches Parkinsonsyndrom (iPS) einher.
- Diabetesprävention – z. B. durch vermehrte körperliche Aktivität sowie eine mediterrane Ernährung – und eine gezielte Diabetestherapie mit DPP-4-Hemmern oder GLP-1-RA wirken mutmaßlich protektiv bezüglich iPS.
Erschienen in: doctors|today, 2022; 2 (4) Seite 48-50