Ältere Patienten leiden relativ häufig an einer Anämie. Schon deren "milde" Form kann schaden. Eine adäquate Abklärung im Alter wird jedoch oft durch Polypharmazie bzw. Multimedikation erschwert. Auch in der Therapie, z. B. bei der Eisen- oder Vitamin-B12-Substitution, gibt es einige Fallstricke, die der Arzt aber gut umgehen kann: durch ein manuelles Differenzialblutbild.
Die Anämie (nach WHO-Definition, Tabelle 1 [1]) ist sicher eine der häufigsten erfassten Laborabweichungen. Global hat jeder dritte Mensch eine Blutarmut [2]. In Westeuropa ist mindestens jeder 20. Patient im hausärztlichen Setting anämisch – im höheren Alter nimmt die Inzidenz noch deutlich zu [3]. Anämien oder subklinische Eisendefizienz beeinträchtigen die Lebensqualität und führen u. a. zu eingeschränkter Herzfunktion, vermehrter Operations- und Schlaganfallsterblichkeit und verminderter Hirnleistung [4 – 7].
Die Anämieabklärung erweist sich wegen der Vielzahl ihrer möglichen Ursachen als schwierig. Die Blutarmut ist bei akuten Anämien meist ausgeprägter als bei chronisch anämischen Zuständen. Unspezifische, aber häufige Hinweise auf Eisendefizienz sind Kopfschmerzen, Haarausfall und Schwäche. Auch die Symptomatik ursächlicher Erkrankungen (rheumatischer, chronisch entzündlicher Formenkreis, Malassimilation, Malignome etc.) ist wichtig. Genaue Daten zur Häufigkeit der Anämie beim Allgemeinarzt gibt es nicht. Bei älteren Patienten schätzt man, dass je ein Drittel der Anämien durch chronische Erkrankungen (ACD), durch Minderversorgung (Vitamin-B12-/Folsäure- oder Eisenunterversorgung) oder multifaktoriell (häufig ätiologisch unklar!) bedingt ist.
Rationale und rationelle Labordiagnostik
Bei der Anämieabklärung gibt es nicht den einen verlässlichen diagnostischen Algorithmus! Da eine Anämie immer ein Ungleichgewicht zwischen Erythrozytenproduktion (pro Sekunde ≥ 2 Mio. Erythrozyten beim Gesunden [8]) und Erythrozytenabbau ist, sollte dieser Frage zuerst nachgegangen werden: Wurden (gemessen am Bedarf!) zu wenig Erythrozyten produziert oder zu viele abgebaut bzw. verloren? Hierzu eignet sich der Retikulozytenproduktionsindex (RPI, vgl. Kasten 1).
- Keine Anämie: RPI = 1
- Anämie mit adäquater Erythropoese-Reaktion des KM: RPI > 2
- Anämie mit inadäquater Erythropoese-Reaktion des KM: RPI < 2
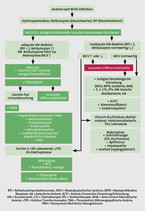
Das Blutbild liefert die Erythrozytenindizes (MCV, MCH, MCHC) automatisch mit. Insbesondere das MCV lässt sich aber nur mit der vorliegenden Zahl der Retikulozyten adäquat interpretieren. Eine Retikulozytose führt generell zu einem erhöhten MCV. Vor allem bei älteren Patienten liegt häufig mehr als eine Anämieursache vor (z. B. Eisenverlust bei chronischer Gastritis und Marcumartherapie sowie Vitamin-B12-Mangel aufgrund der dauerhaften PPI-Therapie), was normwertige MCV-Werte bedingen kann. Ein möglicher strukturierter Algorithmus zur vordergründigen Abklärung einer neu diagnostizierten Anämie kann aber nur als Orientierung dienen (Abb. 1).
Tabelle 2 zeigt eine Übersicht sinnvoller Parameter zur Anämieabklärung. Mögliche weitere hilfreiche Befunde sind: Urinuntersuchung (Erythrozyturie? Hämoglobinurie?), CRP, BSG, Leber- und Nierenwerte, LDH, Bilirubin und Milzgröße sowie Leberbeschaffenheit.
Unerlässlich ist der manuelle Blutausstrich [9]. Pathologische Erythrozytenformen, Einschlusskörperchen oder auffällige Granulozyten können Hinweise auf so unterschiedliche Anämieursachen geben wie Hämoglobinopathien, Myelodysplastische Syndrome, Myelofibrose, Lebererkrankungen, Mikroangiopathien, Vitamin-B12-Mangel, Kugel- oder Sichelzellanämie und viele andere.
Eine gründliche Anämieabklärung sollte also spätestens in der "zweiten Runde" der durchgeführten Untersuchungen ein manuelles Differenzialblutbild beinhalten. Die "erste Runde" sollte neben den Retikulozyten (manche Labore bestimmen darüber hinaus den Retikulozyten-Hb, vgl. Tabelle 2) auch die Ferritin-Bestimmung umfassen (CAVE Akut-Phase-Protein: keine Ferritinbestimmung ohne gleichzeitige CRP- und Leberwert-Bestimmung!). Denn eine eisendefiziente Erythropoese ist nach wie vor die häufigste Anämieursache. Retikulozyten sollte der Arzt auch immer als Absolutzahlen in Laborbefunden anfordern. Prozent- oder Promille-Angaben sind nicht hilfreich!
Häufige Fallstricke
-
Inadäquate Eisensubstitution
Die ungeliebte orale Eisensubstitution wird nach unserer Erfahrung meist zu kurz oder "incompliant" durchgeführt. Eine Kontrolle der Retikulozytenzahl 10 bis 14 Tage nach Beginn einer Eisentherapie zeigt an, ob Patienten ihr Präparat auch einnehmen. Zudem steigt ohne Beseitigung der Eisenverlustursache auch bei adäquater Eisentherapie der Hb-Wert allenfalls gering an. Allerdings werden auch bei regelmäßiger Eisenpräparateinnahme täglich maximal 10 mg Eisen aufgenommen (vgl. Kasten 2). Eine suffiziente orale Eisensubstitution sollte in der Regel mindestens so lange fortgeführt werden, wie es bis zur Normalisierung des Hb-Werts gedauert hat. Selten sind weniger als sechs Monate Substitution ausreichend. Neuere Daten lassen zudem vermuten, dass eine alternierende orale Eiseneinnahme (also jeden zweiten Tag) einer täglichen Gabe überlegen sein kann [10, 11]. Als erfolgreiche und gut verträgliche Alternative erweist sich die intravenöse Eisengabe, die zudem eine "One-Stop-Shop"-Strategie durch die einmalige, hochdosierte Eisensupplementierung erlaubt.
-
Furcht vor intravenöser Eisentherapie
Über zwei Drittel aller Patienten beklagen signifikante gastrointestinale Nebenwirkungen unter oraler Eisentherapie. Die heutigen intravenösen Eisenpräparate – dreiwertiger Glukonat-Komplex (Ferrlecit®), Eisen-Carboxymaltose (Ferinject®), Hydroxid-Saccharose-Komplex (Venofer®) – sind bei langsamer Infusionsgeschwindigkeit in Dosen bis zu 500 – 1.000 mg gut verträglich (Nebenwirkungsrate 1:200.000). Sie erlauben eine rasche Korrektur eisendefizienter Zustände [12]. Vor allem Patienten mit ACD, chronisch entzündlichen Darmerkrankungen und Anämien bei Krebserkrankungen profitieren von intravenösen Eisengaben und können aufgrund des intrinsisch erhöhten Hepcidins nicht ausreichend mit oralen Eisenpräparaten substituiert werden [13].
-
Ungeklärte eisenrefraktäre Eisenmangelanämie
Bei vielen Menschen bessert sich der Eisenmangel nicht – trotz invasiver gastroenterologischer Abklärung und adäquater oraler Eisensubstitution. Studien zeigen, dass ein Großteil der Patienten eine Autoimmungastritis, eine H. Pylori-Gastritis oder eine Zöliakie hat – Frauen leiden häufig unter einer unterdiagnostizierten Menorrhagie [14]. Seltene, genetisch bedingte Eisenstoffwechselstörungen als Ursache einer sogenannten IRIDA (Iron Refractory Iron Deficient Anemia) werden am ehesten bei jungen Patienten mit oft hohen Ferritinwerten beobachtet. Zur Gendiagnostik ist hier die Überweisung an spezialisierte Zentren empfohlen.
-
Makrozytose nicht gleich Substratmangel
Eine Makrozytose (MCV > 100 fl) wird häufig mit einem Substratmangel (Vitamin-B12- und/oder Folsäuremangel) gleichgesetzt. Allerdings führt auch jede Retikulozytose zur Makrozytose. Patienten mit Substratmangel haben nicht selten auch einen Eisenmangel (und damit normwertige MCV-Werte). Zahlreiche weitere Ursachen (Alkoholismus, Lebererkrankungen, Hypothyreoidismus u. a.) oder Artefakte (Hyperglykämie, Agglutinate) können eine Makrozytose bedingen [15]. Auch führt eine große Zahl von Medikamenten zu verminderter Folsäure- oder Vitamin-B12-Bereitstellung [16]. Besonders erwähnt seien hier die Protonenpumpeninhibitoren, die teils unkritisch breit zum Einsatz kommen [17].
-
Vitamin-B12- und Folsäure-Bestimmung
Folsäurespiegel im Serum unterliegen vielen Schwankungen wie Fehlernährung (Krankenhausaufenthalte!) oder Alkoholgenuss. Sie führen zu falsch niedrigen, jede geringe Hämolyse zu falsch hohen Folsäureserumspiegeln [18]. Auch die Vitamin-B12-Bestimmung ist unzuverlässig [19]. Normale Vitamin-B12-Spiegel schließen einen Mangel daher nicht aus. Bei Verdacht auf einen Substratmangel sollte man weitere Parameter bestimmen (Tabelle 2).
-
Multifaktorielle und seltene Ursachen
Gerade bei älteren Patienten führen Anämien zu Morbidität und Mortalität. 30 – 50 % sind multifaktoriell bedingt und bleiben häufig ungeklärt. Bis zu 5 % der Älteren weisen allerdings ein Myelodysplastisches Syndrom (MDS) auf. Eine fachärztliche hämatologische Bewertung scheint hier sinnvoll [4]. Spezifische erfolgreich therapierbare Anämieursachen sind seltene Erkrankungen wie Paroxysmale Nächtliche Hämoglobinurie (PNH), hereditäre Anämien (z. B. Fanconi-Anämie) und durch Medikamente immunvermittelte Anämien [20 – 22].
- Eisenbedarf in mg = (Soll-Hb [g/dl] – gemessener Hb [g/dl]) x 200 + 250 mg (Speichereisen)
- Eisenbedarf in mg = Gewicht in kg x 3,5 x (Soll-Hb [g/dl] – gemessener Hb [g/dl])
Schnittstelle Hausarzt – Spezialist
Eine fachärztlich hämatologische Vorstellung sollte bei pathologischem manuellen Differenzialblutbild mit Hinweis auf maligne Pathologien, bei V. a. hämolytische Anämien sowie ggf. bei "therapierefraktären Patienten" erfolgen. Auch die durch Migration zunehmende Anzahl von Hämoglobinopathien erfordert meist die Versorgung an spezialisierten Zentren. In enger Absprache zwischen fachärztlichen Diagnostikern und Hausärzten können die meisten Patienten jedoch nach genauer Diagnosestellung heimatnah adäquat versorgt werden.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2018; 40 (10) Seite 44-48