Sie gilt als Chamäleon der Medizin: die Zöliakie. Die immunologisch bedingte, durch das Getreideeiweiß Gluten getriggerte Systemerkrankung entwickelt sich meist schon im Kleinkindalter. Obwohl mit den Autoantikörpern gegen Gewebstransglutaminase (tTG-IgA) ein sehr sensitiver und spezifischer Serologietest verfügbar ist, wird nur ein Bruchteil der Patienten korrekt diagnostiziert. Die neuen Leitlinien der Europäischen Gesellschaft für Pädiatrische Gastroenterologie, Hepatologie und Ernährung (ESPGHAN) stellen die Zöliakie-Serologie in den Vordergrund.
Zöliakie ist eine immunologisch vermittelte Systemerkrankung mit Enteropathie und wird bei genetisch prädisponierten Personen (HLA-DQ2 und/oder -DQ8) durch Gluten getriggert (vgl. Kasuistik). Mit einer Prävalenz von etwa 1 % in der Normalbevölkerung ist sie alles andere als selten [1] und die Dunkelziffer hoch: Nur 10 % der Betroffenen werden erkannt [2].
Auch falsch-positive Diagnosen durch ungeeignete Tests oder Fehlinterpretationen der Befunde sind in der Praxis häufig und führen zu unnötigen Einschränkungen der Patienten.
Symptome und Risikogruppen
Viele Ärzte nehmen fälschlicherweise an, Zöliakie ginge immer mit gastrointestinalen beziehungsweise Malabsorptions-Symptomen wie chronischer Diarrhö, Bauchschmerzen, Gewichtsverlust oder Gedeihstörung einher. Die neuen Leitlinien betonen hingegen die Bedeutung unspezifischer Anzeichen wie Müdigkeit oder erhöhter Leberwerte (vgl. Tabelle 1) [3]. Ein deutlich erhöhtes Zöliakierisiko besteht bei erstgradig Verwandten von Zöliakiebetroffenen sowie bei Patienten mit anderen Autoimmunerkrankungen oder bestimmten Syndromen [3, 4].
Hier sollten vom zweiten bis sechsten Lebensjahr jährliche, vom sechsten bis 18. Lebensjahr alle zwei bis drei Jahre Kontrollen auf die Zöliakie-spezifischen Autoantikörper gegen Gewebstransglutaminase (tTG-IgA) erfolgen, selbst wenn es (noch) keine Anzeichen einer unbehandelten Zöliakie gibt. Für eine zeitnahe Diagnose sollte der Arzt bei entsprechender Anamnese immer an die Testung auf Zöliakie-spezifische Antikörper denken.
Screening auf Zöliakie-spezifische Antikörper
Die neuen ESPGHAN-Leitlinien empfehlen als initialen Test bei Verdacht oder zum Ausschluss einer Zöliakie nur die Bestimmung von Autoantikörpern gegen Gewebs-Transglutaminase (tTG-IgA) kombiniert mit Gesamt-IgA (Tabelle 2). Dieses Vorgehen bietet eine sehr hohe diagnostische Treffsicherheit und erlaubt selbst bei geringem Verdacht ein großzügiges Screening. Die Kosten für gesetzlich versicherte Patienten betragen dafür etwa zehn Euro. Ausschließlich bei selektivem IgA-Mangel oder niedrigem Gesamt-IgA (circa 2 – 3 % der Fälle) ist die Testung von IgG-basierten Antikörpern gegen Gewebstransglutaminase (tTG-IgG), Endomysium (EMA-IgG) oder deamidierte Gliadinpeptide sinnvoll [3]. Dieses Vorgehen bietet die höchste Kosten-Nutzen-Effizienz. Einige Labore haben auf dem Anforderungsschein lediglich eine allgemeine "Zöliakie-Serologie" zur Auswahl. Hier sollte der Arzt initial explizit nur tTG-IgA und Gesamt-IgA anfordern.
Weiterführende Diagnostik
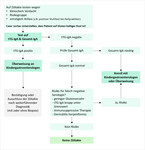
Entsprechend den Befunden von tTG-IgA und Gesamt-IgA erfolgt die weitere Diagnostik (Abb. 1). Bei eindeutig negativem tTG-IgA und gleichzeitig normalem oder erhöhtem Gesamt-IgA ist eine Zöliakie mit sehr hoher Wahrscheinlichkeit auszuschließen, sofern keine Risiken für falsch-negative Serologie (immunsuppressive Therapie, geringer Glutenverzehr, V. a. Dermatitis herpetiformis Duhring) vorliegen. Bei Patienten mit klinischen Symptomen sollte man andere Differenzialdiagnosen in Betracht ziehen.
In allen anderen Fällen empfehlen die Leitlinien entweder eine konsiliarische Beratung oder eine direkte Überweisung an einen Kindergastroenterologen [3]:- positive tTG-IgA
- negative tTG-IgA, aber Risiko für falsch- negative Serologie aufgrund
- immunsuppressiver Therapie
- geringem Glutenverzehr
- V. a. Dermatitis herpetiformis Duhring
- niedriges Gesamt-IgA oder selektiver IgA-Mangel
- tTG-IgA knapp unterhalb oder oberhalb (ca. 1- bis 3-fach) des Grenzwerts
Im letztgenannten Fall ist die ausreichend hohe Glutenzufuhr infrage zu stellen und eine Kontrolle der Serologie nach einigen Wochen mit gesteigertem Glutenkonsum empfohlen, vor allem wenn noch keine oder nur geringe Beschwerden vorliegen. Bei Risikogruppen wie bei Patienten mit Typ-1-Diabetes oder positiver Familienanamnese sind transient oder fluktuierend niedrig positive tTG-IgA keine Seltenheit, haben jedoch in der Regel (noch) keinen Krankheitswert.
In folgenden Situationen muss der Kindergastroenterologe zur Diagnosesicherung eine obere Endoskopie mit Entnahme von mindestens fünf Duodenalbiopsien durchführen:- positive tTG-IgA unterhalb des 10-Fachen des Grenzwerts für den jeweiligen Test
- positive IgG-basierte Antikörper (tTG-/EMA-oder DGP-IgG) bei IgA-Mangel/niedrigem Gesamt-IgA
- Marsh 0: normale Zotten- und Kryptenarchitektur
- Marsh 1: unspezifische Zunahme der intraepithelialen Lymphozyten (IEL, ≥ 25 auf 100 Enterozyten)
- Marsh 2: zusätzlich Kryptenhyperplasie
- Marsh 3 (A – C): zusätzlich (sub-)totale Zottenatrophie
Bei positiver Serologie in Kombination mit Marsh 2 oder 3 (A – C) gilt die Diagnose Zöliakie gesichert [3, 4]. Lautet der Befund Marsh 0 oder 1 ist zu hinterfragen, ob der Glutenverzehr in der Wartezeit bis zur Endoskopie reduziert worden war, ob zu wenig Biopsien entnommen wurden oder ob eine inkorrekte Orientierung der Biopsien zu Zottenartefakten und einer falschen Befundung geführt hat. Erst wenn diese Fallstricke ausgeschlossen und EMA-IgA-Autoantikörper positiv getestet wurden, spricht man von einer potenziellen Zöliakie. Der Patient bleibt in der Regel auf Normalkost, und es erfolgen engmaschige Verlaufskontrollen, zu gegebener Zeit eine Re-Endoskopie. Bei einer Zottenatrophie als Zufallsbefund einer oberen Endoskopie bei gleichzeitig negativer Serologie ist eine Zöliakie extrem unwahrscheinlich. Andere Differenzialdiagnosen einer Zottenatrophie sollte man ebenfalls bedenken [7].
Diagnosesicherung ohne Biopsie
Sehr hohe tTG-IgA (≥ 10-Faches des Grenzwerts) sagen fast immer eine Zottenatrophie voraus. Bereits in den Leitlinien von 2012 wurde daher die Möglichkeit einer Diagnosesicherung ohne Biopsie und Histopathologie als Option genannt [4]. Eine große, prospektive Multicenterstudie bestätigte dieses Vorgehen als sicher mit einem positiven prädiktiven Wert von > 99 % [8]. Alle der folgenden Kriterien müssen für die Diagnose ohne Biopsie erfüllt sein [3]:- tTG-IgA ≥ 10-Faches des Grenzwerts des jeweiligen Tests (mit linearer Kalibrierungskurve)
- Aufklärung der Eltern und gegebenenfalls des Patienten durch einen Kindergastroenterologen über Vor- und Nachteile der Diagnosesicherung mit und ohne Biopsie
- Positive EMA-IgA in einer zweiten Blutentnahme
Das Vorliegen von Symptomen sowie die relativ teure Typisierung der genetischen Zöliakiemarker HLA-DQ2/DQ8 ist nach den neuen Leitlinien für dieses Szenario nicht mehr nötig. Die Genetik hat ihre Berechtigung in unklaren Fällen, z. B. wenn der Patient schon länger eine glutenfreie Diät befolgt. Bei negativen HLA-Markern ist die Zöliakie dann ausgeschlossen, sofern bei der Typisierung alle relevanten Risikoallele berücksichtigt wurden [3]. Ein positiver Nachweis beweist aber keinesfalls die Zöliakie.
Therapie und Verlaufskontrolle
Trotz intensiver Forschung besteht die einzige, aber sehr wirksame Therapie in einer lebenslangen, streng glutenfreien Ernährung [3].
Aber erst, wenn die Diagnose gesichert ist, darf man mit der Diät beginnen. Da die glutenfreie Ernährung komplex ist und den Alltag sowie die Lebensqualität der Betroffenen deutlich einschränkt, sollte immer eine Diätberatung durch eine geschulte und mit Zöliakie erfahrene Ernährungsfachkraft erfolgen, wie sie an kindergastroenterologischen Zentren in der Regel angeboten wird [4, 9]. Ein sehr gutes Betreuungs- und Informationsangebot bietet zusätzlich die Deutsche Zöliakie Gesellschaft e. V. .
- Anamnese inklusive Einhaltung der glutenfreien Diät
- Anthropometrie (Perzentilen für Längenwachstum, Gewicht, BMI)
- Pubertätsstadien nach Tanner
- tTG-IgA (oder IgG-basierte Antikörper bei niedrigen Gesamt-IgA)
Eine Routine-Endoskopie zur Verlaufskontrolle ist weder bei Kindern noch bei Erwachsenen nötig [4, 11]. Bei fehlendem klinischem und/oder serologischem Ansprechen kann eine erfahrene Ernährungsberatung gemeinsam mit Patient und Eltern Diätfehler identifizieren und Lösungen finden. Die refraktäre Form der Zöliakie (Nichtansprechen trotz strenger Einhaltung der Diät) kommt nur in seltenen Fällen bei Erwachsenen, nicht aber im Kindesalter vor.
Eine langfristige Vorbereitung des Patienten hinsichtlich der eigenverantwortlichen Einhaltung der glutenfreien Ernährung und der Vereinbarung regelmäßiger Verlaufskontrollen sollte schon vor Eintritt der Pubertät beginnen (strukturierte Transition), um die Grundlage für eine gute Compliance und Krankheitsbewältigung im Erwachsenenalter zu legen [12].
Dr. von Hauner’sches Kinderspital
Klinikum der Ludwig-Maximilians-Universität
80337 München
Interessenkonflikte: KW: keine deklariert, SK erhielt Vortragshonorar der Firma ThermoFischer.Ein kostenloses, von der EU finanziertes interaktives e-Lern-Programm für Betroffene und für medizinisches Fachpersonal finden Sie unter http://www.zoeliakie-verstehen.de
Erschienen in: Der Allgemeinarzt, 2020; 42 (7) Seite 20-23